Die benötigte Wärmemenge für... Präsentation zum Thema: Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist und von ihm beim Abkühlen freigesetzt wird
Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist oder von ihm beim Abkühlen abgegeben wird
Thermische Phänomene
In dieser Lektion kann sich jeder ein Bild vom Thema „Berechnung der Wärmemenge machen, die zum Erhitzen eines Körpers erforderlich ist oder die er beim Abkühlen abgibt.“ Hier werden wir unsere Untersuchung thermischer Phänomene fortsetzen und über die Freisetzung von Wärme sprechen, wenn ein Körper erhitzt oder abgekühlt wird. Wir erfahren, dass dieser Wert von der Masse des Körpers, von der Temperaturdifferenz und von der spezifischen Wärmekapazität des Stoffes abhängt. Betrachten wir die Formeln, die diese Größen verbinden. Und wir analysieren die Lösung eines Problems, um die erforderliche Wärmemenge für gegebene Bedingungen zu ermitteln.
Thema: Thermische Phänomene
Lektion: Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist oder von ihm beim Abkühlen abgegeben wird
In dieser Lektion geht es um die Berechnung der Wärmemenge, die ein Körper beim Erhitzen bzw. beim Abkühlen abgibt.
Fähigkeit zu rechnen erforderliche Menge Wärme ist sehr wichtig. Dies kann beispielsweise bei der Berechnung der Wärmemenge erforderlich sein, die dem Wasser zum Heizen eines Raums zugeführt werden muss. Oder die Wärmemenge, die bei der Verbrennung von Kraftstoff in verschiedenen Motoren freigesetzt wird.
Um die Wärmemenge zu berechnen, müssen Sie drei Dinge wissen:
1. Körpergewicht (das normalerweise mit einer Waage gemessen werden kann).
2. Der Temperaturunterschied, um den ein Körper erwärmt oder gekühlt werden muss (normalerweise gemessen mit einem Thermometer).
3. Spezifische Wärmekapazität des Körpers (kann aus der Tabelle ermittelt werden).
Die Formel zur Berechnung der Wärmemenge lautet wie folgt
In dieser Formel kommen folgende Größen vor:
Die in Joule (J) gemessene Wärmemenge;
Die spezifische Wärmekapazität eines Stoffes wird gemessen in;
- Temperaturunterschied, gemessen in Grad Celsius ().
Betrachten wir das Problem der Berechnung der Wärmemenge.
Ein Kupferglas mit einer Masse von Gramm enthält Wasser mit einem Volumen von Litern bei einer Temperatur von . Wie viel Wärme muss auf ein Glas Wasser übertragen werden, damit die Temperatur gleich wird?
Lösung:
Schreiben wir zunächst einmal auf kurzer Zustand (Gegeben). Und wir werden alle Mengen in das Internationale System (SI) umrechnen.
|
Gegeben: |
SI |
|
|
Finden: |
Lösung:
Stellen wir zunächst fest: Welche weiteren Größen benötigen wir, um dieses Problem zu lösen? Mithilfe der Tabelle der spezifischen Wärmekapazität ermitteln wir (spezifische Wärmekapazität von Kupfer, da das Glas je nach Zustand aus Kupfer besteht), (spezifische Wärmekapazität von Wasser, da sich je nach Zustand Wasser im Glas befindet). Darüber hinaus wissen wir, dass wir die Menge berechnen müssen
Wir werden viel Wasser zum Heizen brauchen. Durch die Bedingung erhalten wir nur Volumen. Daher entnehmen wir der Tabelle die Dichte von Wasser: .
Jetzt haben wir alles, was wir brauchen, um dieses Problem zu lösen.
Beachten Sie, dass sich die endgültige Wärmemenge aus zwei Teilen zusammensetzt: der Wärmemenge, die zum Erhitzen des Kupferglases erforderlich ist, und der Wärmemenge, die zum Erhitzen des Wassers darin erforderlich ist:
Berechnen wir zunächst die Wärmemenge, die zum Erhitzen eines Kupferglases erforderlich ist:
Bevor wir die zum Erhitzen von Wasser erforderliche Wärmemenge berechnen, berechnen wir die Wassermasse mit einer Formel, die uns aus der 7. Klasse bekannt ist:
Jetzt können wir berechnen:
Dann können wir berechnen: .
Erinnern wir uns daran, was Kilojoule bedeuten. Das Präfix „Kilo“ bedeutet ![]() .
.
Antwort:.
Um die Probleme bei der Ermittlung der Wärmemenge (die sogenannten direkten Probleme) und der mit diesem Konzept verbundenen Mengen einfacher zu lösen, können Sie die folgende Tabelle verwenden.
|
Benötigte Menge |
Bezeichnung |
Einheiten |
Grundformel |
Formel für Menge |
|
Wärmemenge |
|
|||
|
Spezifische Wärmekapazität eines Stoffes |
|
|||
|
Körpermasse |
|
|||
|
Anfangstemperatur |
Versuchen Sie, die Formel für die Endtemperatur selbst abzuleiten.
Es ist erwähnenswert, dass Sie sich diese Formeln natürlich nicht merken müssen. Die Hauptsache ist, sich die Grundformel zu merken und daraus alle notwendigen Größen ableiten zu können.
In der nächsten Lektion werden wir dirigieren Labor arbeit, dessen Zweck darin besteht, zu lernen, die spezifische Wärmekapazität eines Festkörpers experimentell zu bestimmen.
1. Gendenshtein L. E., Kaidalov A. B., Kozhevnikov V. B. /Ed. Orlova V. A., Roizena I. I. Physik 8. - M.: Mnemosyne.
2. Peryshkin A.V. Physik 8. - M.: Bustard, 2010.
3. Fadeeva A. A., Zasov A. V., Kiselev D. F. Physik 8. - M.: Bildung.
1. Offenes Bildungsnetzwerk Nowosibirsk ().
2. Festival der pädagogischen Ideen“ Öffentlicher Unterricht» ().
1. Seite 25, Absatz 9, Fragen Nr. 1-4, Übung 4 . Peryshkin A. V. Physik 8. - M.: Bustard, 2010.
2. Finden Sie eine Formel zum Ermitteln der Endtemperatur in Analogie zur Anfangstemperatur aus der Tabelle in der Lektion.
3. Wiegen des Stahlteils bei der Verarbeitung Drehbank aufgeheizt auf . Wie viel Energie hat der Motor aufgewendet, um das Teil zu erwärmen?
4. Wie viel Wärme gibt ein Glas kochendes Wasser mit einem Volumen ab, wenn es auf eine bestimmte Temperatur abkühlt?
Präsentation zum Thema: Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist und von ihm beim Abkühlen freigesetzt wird
1 von 17
Vortrag zum Thema: Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist und von diesem beim Abkühlen abgegeben wird
Folie Nr. 1
Folienbeschreibung:
Folie Nr. 2
Folienbeschreibung:
Ziel der Lektion: Bestimmen Sie die Formel zur Berechnung der Wärmemenge, die zur Änderung der Körpertemperatur erforderlich ist; Analysieren Sie die Formel; Entwicklung praktischer Fähigkeiten zur Lösung von Problemen; lernen Sie weiterhin, die Bedingungen der Aufgabe zu analysieren; die Antworten der Klassenkameraden analysieren und bewerten;
Folie Nr. 3
Folienbeschreibung:
Ohne Wärme gibt es kein Leben. Doch zu viel Kälte und Hitze zerstört alles Lebewesen. Alle Körper, auch Eisblöcke, strahlen Energie ab, schwach erhitzte Körper strahlen jedoch wenig Energie ab und diese Strahlung wird vom menschlichen Auge nicht wahrgenommen. Im 18. Jahrhundert glaubten viele Wissenschaftler, dass Wärme eine besondere Substanz namens Kalorie sei, eine schwerelose „Flüssigkeit“, die in Körpern enthalten sei. Jetzt wissen wir. Es ist nicht so. Heute werden wir über Wärme und thermische Phänomene sprechen und lernen, die Wärmemenge zu berechnen, die zum Erhitzen eines Körpers erforderlich ist und beim Abkühlen freigesetzt wird.
Folie Nr. 4
Folienbeschreibung:
Umfassender Wissenstest 1. Die Energie der Bewegung und Interaktion der Partikel, aus denen der Körper besteht, wird als innere Energie bezeichnet. 2. Die innere Energie eines Körpers kann nicht durch Arbeit an ihm gesteigert werden. 3. Die Übertragung von Energie von einem kälteren Körper auf einen heißeren wird als Wärmeleitfähigkeit bezeichnet. 4. Bei der Wärmeleitung bewegt sich der Stoff nicht von einem Ende des Körpers zum anderen. 5. Konvektion findet in Festkörpern statt. 6. Die Energie, die ein Körper bei der Wärmeübertragung abgibt oder erhält, wird als Wärmemenge bezeichnet. 7. Strahlung ist eine Art Wärmeübertragung. 8. Die Übertragung von Energie von einem Körper auf einen anderen oder von einem Teil davon auf einen anderen erfolgt durch Moleküle oder andere Teilchen. 9. Die innere Energie wird in Newton gemessen. 10. Die zum Erhitzen eines Körpers erforderliche Wärmemenge hängt von der Art des Stoffes ab
Folie Nr. 5
Folienbeschreibung:
Folie Nr. 6
Folienbeschreibung:
Folie Nr. 7
Folienbeschreibung:
Durch Wärmeleitung durch den Boden und die Wände des Topfes wird die innere Energie der Flamme in die innere Energie des Touristeneintopfs umgewandelt. Durch Strahlung – in die innere Energie der Handflächen und Kleidung des Touristen. Und durch Konvektion – in die innere Energie der Luft über dem Feuer.
Folie Nr. 8
Folienbeschreibung:
Qualitative Aufgaben. Aus dem russischen Märchen „Fuchs – Schwester und grauer Wolf" Der Wolf ging zum Fluss, senkte seinen Schwanz in das Loch und begann zu sagen: „Fang, Fische, kleine und große!“ Fange die kleinen und großen Fische!“ Ihm folgte der Fuchs; geht um den Wolf herum und klagt: „Seid klar, macht die Sterne klar am Himmel!“ Einfrieren, einfrieren, Wolfsschwanz! Der Schwanz ist gefroren. In welche Richtung verließ die Hitze den Schwanz des Wolfes? (Strahlung).
Folie Nr. 9
Folienbeschreibung:
Aus dem Altai-Märchen „Das Hermelin und der Hase“. Dachte der weise Bär im Stillen. Ein großes Feuer prasselte heiß vor ihm; über dem Feuer stand auf einem eisernen Dreifuß ein goldener Kessel mit sieben bronzenen Ähren. Der Bär hat diesen geliebten Kessel nie gereinigt: Er hatte Angst, dass das Glück mit dem Schmutz verschwinden würde, und der goldene Kessel war immer mit hundert Schichten Ruß bedeckt, wie Samt. Hat die Tatsache, dass der Kessel mit „hundert Rußschichten“ bedeckt war, die Erwärmung des Wassers beeinflusst? Ja, da Ruß porös ist, erwärmt sich das Wasser langsamer
Folie Nr. 10
Unterricht in der 8. Klasse
Praktische Arbeit Zu diesem Thema:
„Berechnung der Wärmemenge, die zum Erhitzen eines Körpers erforderlich ist oder von ihm beim Abkühlen abgegeben wird.“ Die spezifische Wärmekapazität einer Substanz ermitteln.“
Ziel: Lernen Sie, die Wärmemenge zu berechnen.
Aufgaben:
1. Entwicklung praktischer Fähigkeiten zur Berechnung der zum Heizen erforderlichen und beim Abkühlen freigesetzten Wärmemenge.
2. Entwicklung der Rechenfähigkeiten.
3.Verbesserung der Fähigkeiten zur Vorbereitung physikalischer Probleme.
Planen:
Einführende Motivation
Begrüßung, Festlegung des Unterrichtszwecks, Einteilung in Kleingruppen.
Wissen aktualisieren
Basic
Experimentelle Aufgabe.
Probleme lösen
Bewertung
Durch Karten gelevelt
Betrachtung
Während des Unterrichts:
Einführende Motivation
Hallo Leute!
Wir alle wissen, dass es ohne Wärme kein Leben gibt. Doch zu viel Kälte und Hitze zerstört alles Lebendige. Alle Körper, auch Eisblöcke, strahlen Energie ab, schwach erhitzte Körper strahlen jedoch wenig Energie ab und diese Strahlung wird vom menschlichen Auge nicht wahrgenommen.
Im 18. Jahrhundert glaubten viele Wissenschaftler, dass Wärme eine besondere Substanz namens Kalorie sei, eine schwerelose „Flüssigkeit“, die in Körpern enthalten sei. Jetzt wissen wir, dass dem nicht so ist. Heute werden wir über Wärme und thermische Phänomene sprechen und lernen, wie man die Wärmemenge berechnet, die zum Erhitzen eines Körpers erforderlich ist und beim Abkühlen freigesetzt wird.
Aufteilung in kleine Gruppen Auf Ihren Schreibtischen hängen Aufkleber verschiedene Farben Bitte tauschen Sie die gelben in die rechte Reihe, die grünen in die linke Reihe.
2. Wissen aktualisieren Qualitätsprobleme lösen. (auf dem Poster)
2.1 Aus dem russischen Märchen „Kleiner Fuchs – Schwester und grauer Wolf“. Der Wolf ging zum Fluss, senkte seinen Schwanz in das Loch und begann zu sagen: „Fang, Fische, kleine und große!“ Fange die kleinen und großen Fische!“ Ihm folgte der Fuchs; geht um den Wolf herum und klagt: „Seid klar, macht die Sterne klar am Himmel!“ Einfrieren, einfrieren, Wolfsschwanz! Der Schwanz ist gefroren. In welche Richtung verließ die Hitze den Schwanz des Wolfes? (Strahlung).
2.2 Aus dem Altai-Märchen „Das Hermelin und der Hase“. Dachte der weise Bär im Stillen. Ein großes Feuer prasselte heiß vor ihm; über dem Feuer stand auf einem eisernen Dreifuß ein goldener Kessel mit sieben bronzenen Ähren. Der Bär hat diesen geliebten Kessel nie gereinigt: Er hatte Angst, dass das Glück mit dem Schmutz verschwinden würde, und der goldene Kessel war immer mit hundert Schichten Ruß bedeckt, wie Samt. Hat die Tatsache, dass der Kessel mit „hundert Rußschichten“ bedeckt war, die Erwärmung des Wassers beeinflusst? (Ja, da Ruß porös ist, erfolgt die Wassererwärmung langsamer.)
2.3 Vor dem Abheben schlägt die Motte ziemlich lange mit den Flügeln. Warum? ( Der Schmetterling „wärmt sich auf“, wie ein Sportler sich vor einem Rennen aufwärmt. Ein Teil dessen, was sie tut mechanische Arbeit erhöht die innere Energie).
2.4 Schwerpunkt „Feuerfestes Papier“. Der Nagel wird fest in Papier eingewickelt und in der Flamme einer Alkohollampe erhitzt. Das Papier brennt nicht. Warum? ( Eisen hat eine hohe Wärmeleitfähigkeit, sodass fast die gesamte Wärme auf den Nagel übertragen wird und das Papier nicht verbrennt.
3. Grundlegend(Experimentelle Aufgabe).
Experimentieren Sie mit einem gestreiften Glas, Gruppe 1
Ich bedecke die Innenseite eines dünnen Glases mit gleich breiten weißen und schwarzen Papierstreifen. Auf die Außenseite des Glases klebe ich Knöpfe mit Plastilin auf gleicher Höhe, jeweils einen gegen jeden weißen und schwarzen Streifen.
Ich stelle das Glas auf eine Untertasse und stelle eine Kerze genau in die Mitte hinein. Ich zünde eine Kerze an.
Nach einer Weile beginnen die Knöpfe abzufallen. Erklären Sie die Ergebnisse des Experiments . (Antwort: Erstens verschwinden die Knöpfe, die auf die schwarzen Papierstreifen geklebt sind, da sich hier das Glas stärker erwärmt, schwarze Flächen mehr Energie aus der auf sie einfallenden Strahlung absorbieren als weiße).
Eisexperiment Gruppe 2
Legen Sie ein Stück Eis hinein warmes Wasser Nachdem Sie die Temperatur vor dem Schmelzen des Eises berechnet haben, berechnen Sie mithilfe elektronischer Waagen die Masse des Wassers mit Eis. Bestimmen Sie die Wärmemenge, die beim Abkühlen von Wasser freigesetzt wird.
Aufzeichnen und Erläutern der Formel zur Berechnung der Wärmemenge(Student)
Probleme lösen
4. Bewertung
Summativ, Kriterium (Bewertungstabelle)
Bewertungstabelle
Familienname _______________________________________
| Aufgaben | Evaluationskriterien | markieren |
| Qualitative Probleme lösen (auf dem Poster erklären) | „5“ – Arbeit am Poster, korrekte Erklärung der Antwort, Kenntnis der Definition. „4“ – Arbeit am Poster, richtige Erklärung der Antwort. „3“ – Arbeit an einem Poster, Ideenvorschlag. | |
| Experimentelle Aufgabe | „5“ – korrekte Durchführung des Experiments, Kenntnis der Definition, korrekte Erklärung der Antwort. „4“ – korrekte Durchführung des Experiments, korrekte Erklärung der Antwort. „3“ – korrekte Durchführung des Experiments, Ideenvorschlag. | |
| Aufzeichnen und Erläutern der Formel zur Berechnung der Wärmemenge | „5“ ist die korrekte Schreibweise der Formel, Kenntnis der Buchstabennamen und ihrer Bezeichnungen, Kenntnis der Maßeinheiten physikalische Quantitäten. „4“ ist die korrekte Schreibweise der Formel, Kenntnis der Buchstabennamen und ihrer Symbole „3“ – korrekte Aufzeichnung der Formel oder Kenntnis der Buchstabennamen und ihrer Bezeichnungen, Kenntnis der Maßeinheiten physikalischer Größen. | |
| Probleme lösen | „5“ – Richtiges Design Probleme, gutes Kopfrechnen, Formelkenntnisse, Ableitung von Formeln „4“ – Richtige Formulierung des Problems, Kenntnis der Formel, Ableitung der Formel „3“ – Richtige Formulierung des Problems, Kenntnis der Formel | |
| Ergebnis |
5. D/z Durch Karten gelevelt
Stufe 3"
Wie groß ist die spezifische Wärmekapazität eines Stoffes?
Was ist die Einheit der spezifischen Wärmekapazität eines Stoffes?
Die spezifische Wärmekapazität von Kupfer beträgt 400 J/kg*C. Was bedeutet das?
Bestimmen Sie anhand der Tabelle im Lehrbuch, welcher Stoff die höchste spezifische Wärmekapazität und welcher Stoff die niedrigste spezifische Wärmekapazität hat.
Schreiben Sie eine Formel zur Berechnung der Wärmemenge.
Level 4"
1. Welches Utensil eignet sich besser, um heißen Tee zu trinken: ein Aluminiumbecher oder ein Porzellanbecher? Warum?
2. Welche Wärmemenge wird benötigt, um 2 kg Zink auf 2 0 C zu erhitzen?
3. Berechnen Sie die Wärmemenge, die erforderlich ist, um ein 1,5 kg schweres Gusseisen zu erhitzen, um seine Temperatur um 20 0 C zu ändern.
Level 5"
Wenn Sie zwei unkalibrierte Thermometer haben, wie können Sie dann feststellen, welches heißer ist als das andere?
Vergleichen Sie die Wärmemenge, die erforderlich ist, um Eisen- und Bleibarren um 20 °C zu erhitzen, wenn: a) die Masse der Barren gleich ist; b) die Volumina der Balken sind gleich.
Berechnen Sie die Wärmemenge, die erforderlich ist, um ein 2 kg schweres Gusseisen zu erhitzen, um seine Temperatur um 200 °C zu ändern.
Betrachtung
Ich habe eine Klasse lang im Unterricht gearbeitet…..
Ich habe mein Wissen bestätigt………..
Die Aufgaben waren:
Ich kann es schaffen
Ich habe den Stoff nicht verstanden......
721. Warum wird Wasser zur Kühlung einiger Mechanismen verwendet?
Wasser hat eine hohe spezifische Wärmekapazität, was eine gute Wärmeabfuhr aus dem Mechanismus ermöglicht.
722. In welchem Fall muss mehr Energie aufgewendet werden: um einen Liter Wasser um 1 °C zu erhitzen oder um einhundert Gramm Wasser um 1 °C zu erhitzen?
Um einen Liter Wasser zu erhitzen, muss umso mehr Energie aufgewendet werden, je größer die Masse ist.
723. Kupfernickelsilber und Silbergabeln gleicher Masse wurden in heißes Wasser getaucht. Erhalten sie die gleiche Wärmemenge aus dem Wasser?
Die Kupfernickel-Gabel wird dadurch mehr Wärme abbekommen spezifische Wärme Kupfernickel mehr als Silber.
724. Ein Stück Blei und ein Stück Gusseisen gleicher Masse wurden dreimal mit einem Vorschlaghammer geschlagen. Welches Stück wurde heißer?
Blei erwärmt sich stärker, da seine spezifische Wärmekapazität geringer als die von Gusseisen ist und weniger Energie zum Erhitzen des Bleis benötigt wird.
725. Ein Kolben enthält Wasser, der andere enthält Kerosin gleicher Masse und Temperatur. In jeden Kolben wurde ein gleichermaßen erhitzter Eisenwürfel gegeben. Was wird auf eine höhere Temperatur erhitzt – Wasser oder Kerosin?
Kerosin.
726. Warum sind die Temperaturschwankungen im Winter und Sommer in Städten am Meeresufer weniger stark als in Städten im Landesinneren?
Wasser erwärmt sich und kühlt langsamer ab als Luft. Im Winter kühlt es ab und transportiert warme Luftmassen an Land, wodurch das Klima an der Küste wärmer wird.
727. Die spezifische Wärmekapazität von Aluminium beträgt 920 J/kg °C. Was bedeutet das?
Das bedeutet, dass zum Erhitzen von 1 kg Aluminium um 1 °C 920 J aufgewendet werden müssen.
728. Aluminium- und Kupferstäbe mit der gleichen Masse von 1 kg werden um 1 °C abgekühlt. Wie stark wird sich die innere Energie jedes Blocks ändern? Für welchen Balken wird es sich stärker ändern und um wie viel?
729. Welche Wärmemenge wird benötigt, um ein Kilogramm Eisenbarren auf 45 °C zu erhitzen?

730. Welche Wärmemenge wird benötigt, um 0,25 kg Wasser von 30 °C auf 50 °C zu erhitzen?

731. Wie verändert sich die innere Energie von zwei Litern Wasser bei einer Erwärmung um 5 °C?

732. Welche Wärmemenge wird benötigt, um 5 g Wasser von 20 °C auf 30 °C zu erhitzen?

733. Welche Wärmemenge wird benötigt, um eine 0,03 kg schwere Aluminiumkugel auf 72 °C zu erhitzen?
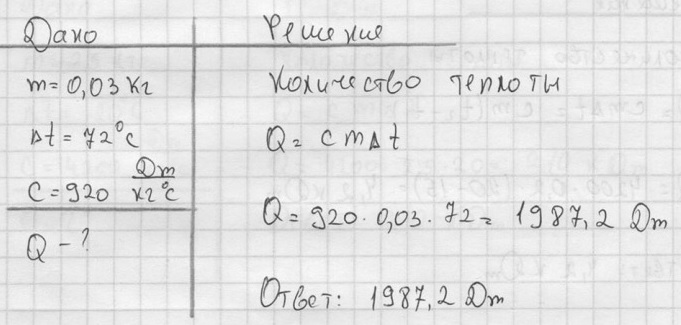
734. Berechnen Sie die Wärmemenge, die erforderlich ist, um 15 kg Kupfer um 80 °C zu erhitzen.

735. Berechnen Sie die Wärmemenge, die erforderlich ist, um 5 kg Kupfer von 10 °C auf 200 °C zu erhitzen.

736. Welche Wärmemenge wird benötigt, um 0,2 kg Wasser von 15 °C auf 20 °C zu erhitzen?

737. Wasser mit einem Gewicht von 0,3 kg ist um 20 °C abgekühlt. Um wie viel hat die innere Energie des Wassers abgenommen?

738. Welche Wärmemenge wird benötigt, um 0,4 kg Wasser mit einer Temperatur von 20 °C auf eine Temperatur von 30 °C zu erhitzen?

739. Welche Wärmemenge wird aufgewendet, um 2,5 kg Wasser um 20 °C zu erhitzen?

740. Wie viel Wärme wurde freigesetzt, als 250 g Wasser von 90 °C auf 40 °C abgekühlt wurden?

741. Welche Wärmemenge ist nötig, um 0,015 Liter Wasser um 1 °C zu erhitzen?

742. Berechnen Sie die Wärmemenge, die benötigt wird, um einen Teich mit einem Volumen von 300 m3 um 10 °C zu erwärmen?
![]()
743. Wie viel Wärme muss 1 kg Wasser zugeführt werden, um seine Temperatur von 30 °C auf 40 °C zu erhöhen?

744. Wasser mit einem Volumen von 10 Litern ist von einer Temperatur von 100 °C auf eine Temperatur von 40 °C abgekühlt. Wie viel Wärme wurde dabei freigesetzt?

745. Berechnen Sie die Wärmemenge, die erforderlich ist, um 1 m3 Sand um 60 °C zu erhitzen.

746. Luftvolumen 60 m3, spezifische Wärmekapazität 1000 J/kg °C, Luftdichte 1,29 kg/m3. Wie viel Wärme ist nötig, um die Temperatur auf 22 °C zu erhöhen?

747. Wasser wurde um 10 °C erhitzt, wobei 4,20·103 J Wärme verbraucht wurden. Bestimmen Sie die Wassermenge.

748. 20,95 kJ Wärme wurden auf 0,5 kg schweres Wasser übertragen. Wie hoch war die Wassertemperatur, wenn die anfängliche Wassertemperatur 20 °C betrug?

749. Eine 2,5 kg schwere Kupferpfanne wird mit 8 kg Wasser von 10 °C gefüllt. Wie viel Hitze ist nötig, um das Wasser in der Pfanne zum Kochen zu bringen?

750. Ein Liter Wasser mit einer Temperatur von 15 °C wird in eine 300 g schwere Kupferpfanne gegossen. Welche Wärmemenge ist nötig, um das Wasser in der Pfanne auf 85 °C zu erhitzen?

751. Ein 3 kg schweres Stück erhitzten Granits wird in Wasser gelegt. Granit überträgt 12,6 kJ Wärme an Wasser und kühlt dabei um 10 °C ab. Wie groß ist die spezifische Wärmekapazität des Steins?

752. Heißes Wasser von 50 °C wurde zu 5 kg Wasser von 12 °C gegeben, wodurch eine Mischung mit einer Temperatur von 30 °C entstand. Wie viel Wasser hast du hinzugefügt?

753. Wasser von 20 °C wurde zu 3 Litern Wasser von 60 °C hinzugefügt, wodurch Wasser von 40 °C erhalten wurde. Wie viel Wasser hast du hinzugefügt?

754. Wie hoch wird die Temperatur der Mischung sein, wenn Sie 600 g Wasser von 80 °C mit 200 g Wasser von 20 °C mischen?

755. Ein Liter Wasser von 90 °C wurde in Wasser von 10 °C gegossen, und die Wassertemperatur betrug 60 °C. Wie viele waren es kaltes Wasser?

756. Bestimmen Sie, wie viel in das Gefäß gegossen werden soll heißes Wasser, auf 60 °C erhitzt, wenn das Gefäß bereits 20 Liter kaltes Wasser mit einer Temperatur von 15 °C enthält; Die Temperatur der Mischung sollte 40 °C betragen.

757. Bestimmen Sie, wie viel Wärme erforderlich ist, um 425 g Wasser um 20 °C zu erhitzen.

758. Um wie viel Grad erhitzen sich 5 kg Wasser, wenn das Wasser 167,2 kJ erhält?

759. Wie viel Wärme ist erforderlich, um m Gramm Wasser von der Temperatur t1 auf die Temperatur t2 zu erhitzen?

760. 2 kg Wasser werden bei einer Temperatur von 15 °C in ein Kalorimeter gegossen. Auf welche Temperatur erwärmt sich das Wasser des Kalorimeters, wenn man ein auf 100 °C erhitztes Messinggewicht von 500 g hineinlässt? Die spezifische Wärmekapazität von Messing beträgt 0,37 kJ/(kg °C).

761. Es gibt Stücke aus Kupfer, Zinn und Aluminium mit demselben Volumen. Welches dieser Teile hat die größte und welches die kleinste Wärmekapazität?

762. 450 g Wasser mit einer Temperatur von 20 °C wurden in das Kalorimeter gegossen. Als 200 g auf 100 °C erhitzte Eisenspäne in dieses Wasser getaucht wurden, betrug die Wassertemperatur 24 °C. Bestimmen Sie die spezifische Wärmekapazität von Sägemehl.

763. Ein 100 g schweres Kupferkalorimeter fasst 738 g Wasser, dessen Temperatur 15 °C beträgt. In dieses Kalorimeter wurden 200 g Kupfer bei einer Temperatur von 100 °C eingetaucht, woraufhin die Temperatur des Kalorimeters auf 17 °C anstieg. Was ist die spezifische Wärmekapazität von Kupfer?

764. Eine 10 g schwere Stahlkugel wird aus dem Ofen genommen und in 10 °C warmes Wasser gelegt. Die Wassertemperatur stieg auf 25 °C. Welche Temperatur hatte die Kugel im Ofen, wenn die Wassermasse 50 g betrug? Die spezifische Wärmekapazität von Stahl beträgt 0,5 kJ/(kg °C).
770. Ein 2 kg schwerer Stahlschneider wurde auf eine Temperatur von 800 °C erhitzt und dann in ein Gefäß mit 15 Litern Wasser bei einer Temperatur von 10 °C abgesenkt. Auf welche Temperatur wird das Wasser im Gefäß erhitzt?
![]()
(Hinweis: Um dieses Problem zu lösen, ist es notwendig, eine Gleichung zu erstellen, in der die unbekannte Temperatur des Wassers im Gefäß nach dem Absenken des Kutters als Unbekannte angenommen wird.)
771. Welche Temperatur erhält das Wasser, wenn man 0,02 kg Wasser von 15 °C, 0,03 kg Wasser von 25 °C und 0,01 kg Wasser von 60 °C mischt?

772. Für die Beheizung einer gut belüfteten Klasse beträgt die benötigte Wärmemenge 4,19 MJ pro Stunde. Wasser tritt mit 80 °C in die Heizkörper ein und verlässt sie mit 72 °C. Wie viel Wasser soll den Heizkörpern pro Stunde zugeführt werden?

773. 0,1 kg schweres Blei mit einer Temperatur von 100 °C wurde in ein 0,04 kg schweres Aluminiumkalorimeter getaucht, das 0,24 kg Wasser mit einer Temperatur von 15 °C enthielt. Danach erreichte die Temperatur im Kalorimeter 16 °C. Wie groß ist die spezifische Wärme von Blei?
