Mahusay na encyclopedia ng langis at gas
Pahina 3
Ngunit ang singil ng nucleus ng potassium atom ay 19, at ang charge ng nucleus ng argon atom ay 18, samakatuwid ang potassium, sa kabila ng mas mababang timbang ng atom nito, ay dapat na nasa periodic table pagkatapos ng argon.
Samakatuwid, ang singil ng nucleus ng isang silicon atom ay katumbas ng - f - 14e at ang atom nito ay naglalaman ng 14 na electron. Gayunpaman, sa mga ito, apat lamang ang mahinang pinagsama. Ito ang mga mahinang nakagapos na mga electron na lumahok mga reaksiyong kemikal at tukuyin ang apat na valence ng silikon, kaya naman tinawag silang valence electron.
Kung ang nuclear charge ng isang hydrogen atom ay nadagdagan ng isa at isa pang electron ang idinagdag, ang resulta ay isang helium atom. Ang parehong mga electron sa atom na ito ay maaaring nasa /(- shell, ngunit may antiparallel spin orientation.
Ano ang singil ng nucleus ng isang atom ng mga sumusunod na elemento: lithium, carbon, oxygen, fluorine, neon, sodium, aluminum, sulfur, chlorine, calcium, iron, zinc, barium, mercury, uranium.
Ang halaga ng singil sa nucleus ng isang atom ay tinutukoy ng bilang ng mga proton na naroroon sa nucleus. Ang masa ng isang atom ay nakasalalay sa bilang ng mga proton at neutron sa nucleus.
Ang pagtaas sa singil ng nucleus ng isang beryllium atom kumpara sa singil ng nucleus ng isang lithium atom, kasama ang katotohanan na ang 23 - mga electron ay bahagyang nagsasanggalang lamang sa isa't isa, ay humahantong sa dalawang epekto: 1) ang Be atom ay may isang metalikong radius na 0 89 A lamang, makabuluhang mas mababa kaysa sa kaso ng lithium (1 22 A); 2) ang mga potensyal na ionization ng Be, 9 32 at 18 21 eV, na mas malaki kaysa sa Li (5 39 eV), ay ginagawang mas kaunting electropositive ang Be kapag isinasaalang-alang mga katangian ng kemikal sa paghahambing sa mga katangian ng Li. Sa katunayan, walang mga mala-kristal na compound o solusyon kung saan umiiral ang mga Be2 ion. Ang lahat ng mga compound na ang mga istruktura ay natukoy, kahit na ang mga may pinakamaraming electronegative na elemento, tulad ng BeO at BeF2, ay hindi bababa sa bahagyang covalent. Ang elektronikong istraktura ng mga atom ng iba pang mga elemento ng pangkat II (Mg, Ca, Sr, Ba at Ra) ay katulad ng istraktura ng Be atom. Gayunpaman mas malaking sukat ng mga atoms na ito ay binabawasan ang impluwensya ng nuclear charge sa valence electron. Kaya, ang kanilang mga potensyal na ionization ay mas mababa kaysa sa Be; sa pangkalahatan sila ay mas electropositive, at ang ionic na katangian ng kanilang mga compound ay natural na tumataas sa grupo mula sa itaas hanggang sa ibaba.
Ang pagtaas ng singil ng nucleus ng beryllium atom kumpara sa singil ng nucleus ng lithium atom, kasama ang katotohanan na ang 25 electron ay bahagyang nagtatanggol sa isa't isa, ay humahantong sa dalawang epekto: 1) ang Be atom ay may isang metalikong radius na 0.89 A lamang, mas mababa kaysa sa kaso ng lithium (1 22 A); 2) ang mga potensyal na ionization ng Be, 9 32 at 18 21 eV, ay mas malaki kaysa sa Li (5 39 eV), na ginagawang mas mababa ang electropositive ng Be kapag isinasaalang-alang ang mga kemikal na katangian nito kumpara sa mga katangian ng Li. Sa katunayan, walang mga mala-kristal na compound o solusyon kung saan umiiral ang mga Be2 ion. Ang lahat ng mga compound na ang mga istruktura ay natukoy, kahit na ang mga may pinakamaraming electronegative na elemento, tulad ng BeO at BeF2, ay hindi bababa sa bahagyang covalent. Ang elektronikong istraktura ng mga atom ng iba pang mga elemento ng pangkat II (Mg, Ca, Sr, Ba at Ra) ay katulad ng istraktura ng Be atom. Gayunpaman, ang mas malaking sukat ng mga atom na ito ay binabawasan ang epekto ng nuclear charge sa mga valence electron. Kaya, ang kanilang mga potensyal na ionization ay mas mababa kaysa sa Be; sa pangkalahatan sila ay mas electropositive, at ang ionic na katangian ng kanilang mga compound ay natural na tumataas sa grupo mula sa itaas hanggang sa ibaba.
Ano ang singil ng nucleus ng isang atom?
Ang Z ay ang singil ng atomic nucleus (para sa hydrogen na katumbas ng 1); Ang x, y, z ay ang mga coordinate ng electron.
Ano ang singil ng nucleus ng isang atom ng isang elemento na matatagpuan: a) sa ikatlong pangkat sa ikatlong hanay; b) sa ikaapat na pangkat sa ikaapat na hanay; c) sa ikaanim na pangkat sa ikalimang hanay.
Ano ang singil sa nucleus ng isang mercury atom?
Ano ang singil ng nucleus ng isang titanium atom?
Intrinsic electrical conductivity
Isaalang-alang natin nang mas detalyado ang proseso ng pagbuo ng mga conduction electron sa semiconductors. Upang gawing kongkreto ang mga karagdagang talakayan, isaalang-alang natin ang silikon, na isang tipikal na semiconductor.
Ang silicon atom ay may serial number sa periodic table ng Mendeleev Z=14. Samakatuwid, ang singil ng nucleus ng isang silicon atom ay +14 e at ang atom nito ay naglalaman ng 14 na electron. Gayunpaman, sa mga ito, apat lamang ang mahinang pinagsama. Ang mga mahinang nakagapos na electron na ito ang lumalahok sa mga reaksiyong kemikal at tinutukoy ang apat na valence ng silikon, kaya naman nakuha nila ang pangalan. valence mga electron. Ang natitirang sampung electron kasama ang nucleus ay bumubuo kalansay isang atom na may singil na +14e-10e = +4e. Napapaligiran ito ng apat na valence electron, na gumagalaw sa paligid ng core at bumubuo ng ulap ng negatibong singil (Larawan 316).
Sa silicon na sala-sala, ang pagkakaayos ng mga atomo ay ang bawat atom ay napapaligiran ng apat na pinakamalapit na kapitbahay nito. Pinasimple patag na diagram Ang pagkakaayos ng mga atom nito ay ipinapakita sa Fig. 317.

Ang koneksyon sa pagitan ng dalawang magkalapit na mga atom ay dahil sa isang pares ng mga electron na bumubuo ng tinatawag na pares-electronic o valence, koneksyon.
Ang larawan na ipinapakita sa Fig. 317, ay tumutugma sa purong silikon (ang impluwensya ng mga impurities ay tatalakayin sa ibaba) at napakababang temperatura. Sa kasong ito, ang lahat ng mga electron ng valence ay lumahok sa pagbuo ng mga bono sa pagitan ng mga atomo at ay istruktural elemento at hindi nakikilahok sa electrical conductivity.
Habang tumataas ang temperatura ng kristal, ang mga thermal vibrations ng sala-sala ay humahantong sa pagkasira ng ilang valence bond. Bilang resulta nito, ang ilan sa mga electron na dating lumahok sa pagbuo ng mga valence bond ay nahati at nagiging conduction electron. Napapailalim sa availability electric field kumikilos sila laban sa larangan at porma agos ng kuryente.
Gayunpaman, bilang karagdagan sa proseso ng paglilipat ng singil gamit ang mga conduction electron, ang isa pang mekanismo ng electrical conductivity ay posible rin. Ito ay dahil sa ang katunayan na ang anumang pagkalagot ng isang valence bond ay humahantong sa hitsura ng isang bakanteng site na may nawawalang bono. Ang nasabing "walang laman" na mga puwang na may nawawalang mga electron ng bono ay tinatawag na "mga butas" (Larawan 318).
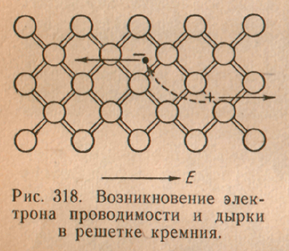
Madaling makita na lumilikha ang hitsura ng mga butas sa isang semiconductor crystal karagdagang pagkakataon para sa paglilipat ng bayad. Sa katunayan, sa pagkakaroon ng isang butas, alinman sa mga electron ng bono ay maaaring lumipat sa lugar ng butas. Bilang resulta, maibabalik ang normal na komunikasyon sa lugar na ito, ngunit may lalabas na butas sa ibang lugar. Sa turn, ang alinman sa iba pang mga electron ng bono ay maaaring lumipat sa bagong butas na ito, atbp. Ang prosesong ito ay magaganap nang paulit-ulit, bilang isang resulta kung saan hindi lamang ang mga conduction electron ay makikibahagi sa pagbuo ng kasalukuyang, kundi pati na rin ang mga electron ng bono. , na unti-unting gagalaw , pati na rin ang mga conduction electron, laban sa electric field. Ang mga butas mismo ay lilipat sa tapat na direksyon, sa direksyon ng electric field, ibig sabihin, habang sila ay gumagalaw. positibo sisingilin na mga particle (Larawan 319).

Tinatawag ang prosesong isinasaalang-alang kondaktibiti ng butas. Dahil dito, dalawang magkaibang proseso ng electrical conductivity ang posible sa semiconductors: electronic, na isinasagawa ng paggalaw ng mga conduction electron, at butas, na dulot ng paggalaw ng mga butas.
Sa unang sulyap, maaaring mukhang ang ideya ng electrical conductivity gamit ang mga butas ay napaka-artipisyal at kahit na hindi makatwiran, dahil ang mga butas, i.e. "walang laman" na mga lugar, ay natural na hindi maaaring ilipat. singil ng kuryente, ngunit sa katotohanan, tulad ng nakita natin, ang paglilipat ng singil ay isinasagawa sa pamamagitan ng paggalaw ng mga electron ng bono. Ang punto, gayunpaman, ay ang paggalaw ng mga electron, gaya ng nabanggit sa itaas, ay sumusunod sa mga batas hindi ng klasikal, ngunit ng quantum mechanics. At ang mga batas ng quantum mechanics ay nagpapakita na kung ang konsentrasyon ng mga butas ay maliit kumpara sa konsentrasyon ng mga bonding electron, kung gayon ang mga simpleng batas ng paggalaw ay nakuha lamang para sa mga butas, ngunit hindi para sa bonding electron. Namely, ito ay lumiliko out na ang mga butas sa electrical at mga magnetic field gumalaw sa parehong paraan kung paano sila gumagalaw positibo sisingilin ang mga particle na may singil + e at ilang tiyak na masa (hindi talaga katumbas ng masa ng elektron). Kaya lang yun lang mga prosesong elektrikal sa pagkakaroon ng mga butas, nangyayari ang mga ito na parang, kasama ang mga negatibong conduction electron, mayroon ding mga positibong sisingilin na mga particle - mga butas.
Kasama ng mga transisyon ng elektron mula sa isang nakatali na estado patungo sa isang malayang estado, may mga reverse transition kung saan ang isang conduction electron ay nakuha sa isa sa mga bakanteng posisyon ng mga bond electron. Ang prosesong ito ay tinatawag na recombination ng electron at hole. Sa isang estado ng balanse, ang gayong konsentrasyon ng mga electron (at isang pantay na konsentrasyon ng mga butas) ay itinatag kung saan ang bilang ng direkta at baligtad na mga paglipat at ang yunit ng oras ng angkop na lugar ay pareho.
Ang itinuturing na proseso ng pagpapadaloy sa ganap na purong semiconductor, ganap na walang mga kemikal na impurities at iba pang mga depekto sa sala-sala, ay tinatawag sariling kondaktibiti.
Impurity electrical conductivity ng semiconductors
Sa pagkakaroon ng mga impurities, ang electrical conductivity ng semiconductors ay nagbabago nang malaki. Ituro natin bilang isang halimbawa na ang silikon na may pagdaragdag ng posporus sa halagang halos 0.001 atomic na porsyento ay may resistivity sa temperatura ng silid na humigit-kumulang 0.006 ohm, mga. ang paglaban nito ay nabawasan ng higit sa 100,000 beses kumpara sa ganap na purong kristal.
Ang impluwensyang ito ng mga impurities ay ganap na ipinaliwanag ng mga ideya sa itaas tungkol sa istraktura ng semiconductors. Balik tayo ulit sa tiyak na halimbawa silikon at ipagpalagay na naglalaman ito ng mga atomo ng mga kemikal na dumi na pumapalit sa ilang mga atomo ng silikon. Bilang isang karumihan, isaalang-alang muna natin ang ilang elemento ng ikalimang pangkat, halimbawa arsenic. Ang arsenic atom, bilang isang pangkat 5 elemento, ay may limang valence electron. Ngunit upang maisagawa ang mga pares-electron bond sa isang silikon na sala-sala, tulad ng nakita natin, apat na electron lamang ang kailangan. Samakatuwid, ang ikalimang electron ng arsenic atom ay lalong mahina ang pagkakatali at madaling mahati sa panahon ng thermal vibrations ng sala-sala. Sa kasong ito, lumilitaw ang isang conduction electron, at ang arsenic atom ay nagiging isang positibong sisingilin na ion. Walang nabuong butas. Ang isang katulad na proseso ay inilalarawan ng eskematiko sa Fig. 320, A.
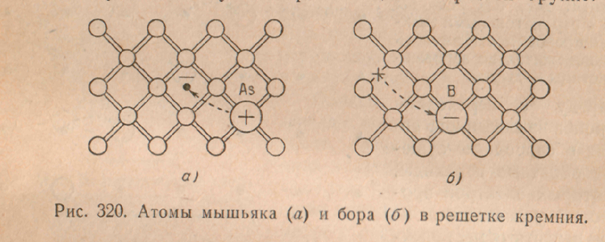
Tingnan natin ngayon kung paano kikilos ang isang impurity atom ng anumang elemento sa kaliwa sa periodic table kaysa sa silikon; hayaan itong maging ang boron na nakatayo sa ikatlong pangkat. Ang isang boron atom ay mayroon lamang tatlong valence electron, habang ang isang normal na valence bond sa isang silicon lattice ay nangangailangan ng apat na electron. Ang nawawalang ikaapat na elektron ay kukunin mula sa mga kalapit na lugar sa kristal, isang butas ang bubuo sa kaukulang lugar, at ang boron atom ay magiging negatibong ion (Larawan 320, A). Kaya, kahit na sa pagkakaroon ng boron sa isang silikon na kristal, posible na magkaroon ng isang kasalukuyang, ngunit, hindi katulad ng kaso ng arsenic, ang electric current dito ay dahil sa paggalaw ng mga butas, hindi mga electron.
Dahil dito, ang electrical conductivity ng semiconductors ay maaari ding sanhi ng mga impurities (karumihan kondaktibiti). Ang mga impurities na nagdudulot ng paglitaw ng mga conduction electron (halimbawa, arsenic sa silicon) ay tinatawag donor ang mga dumi, at mga dumi na nagdudulot ng mga butas (halimbawa, boron sa silicon) ay tinatawag tumanggap.
Ang pagbubuod sa kung ano ang sinabi, nakita namin na ang mga semiconductor ay may kakaiba na ang electrical conductivity sa mga ito ay maaaring dahil sa parehong mga mobile electron at butas. Kung ang konsentrasyon ng mga electron sa isang semiconductor ay makabuluhang mas malaki kaysa sa konsentrasyon ng mga butas, pagkatapos ay sinasabi namin na ang semiconductor ay may elektroniko conductivity, o conductivity n-uri (mula sa negatibo- negatibo). Kung ang mga positibong butas ay makabuluhang nangingibabaw, kung gayon ang electrical conductivity ay tinatawag butas, o p- uri (mula sa positibo- positibo). Ang mga carrier ng singil ay kinakatawan sa karamihan (mga electron sa isang semiconductor n-uri at mga butas sa isang semiconductor p-type), natanggap ang pangalan pangunahing mga tagadala ng bayad, at ang mga kinakatawan sa minorya - hindi core. Kung ang mga konsentrasyon ng mga electron at butas ay maihahambing sa isa't isa, kung gayon mayroon tayo halo-halong kondaktibiti.
Halimbawa, ang silikon na may admixture ng arsenic sa mababang temperatura mayroon lamang impurity conductivity at isang semiconductor n-uri. Ang karamihan sa mga carrier ng singil dito ay mga electron, at ang mga carrier ng minorya ay mga butas. Ang huli ay lumitaw lamang bilang isang resulta ng pagkalagot ng mga valence bond at ang kanilang bilang sa mababang temperatura ay maliit. Ngunit sa pagtaas ng temperatura, ang bilang ng mga naturang proseso ay tumataas at lumilitaw ang kapansin-pansin na intrinsic conductivity. Kasabay nito, ang bilang ng mga butas ay tumataas, at ang uri ng electrical conductivity ay nagiging halo-halong. Sa sapat na mataas na temperatura, ang impurity conductivity, sa kabaligtaran, ay nagiging mas mababa kaysa sa intrinsic conductivity, at ang konsentrasyon ng butas ay nagiging halos katumbas ng konsentrasyon ng elektron.
