“Jednostavne tvari su metali. Jednostavne tvari - metali - Hipermarket znanja
Karakteristična kemijska svojstva jednostavnih tvari – metala
Većina kemijski elementi 92 od 114 poznatih elemenata klasificiraju se kao metali. Metali- to su kemijski elementi čiji atomi odaju elektrone iz vanjskog (a neki i iz vanjskog) sloja elektrona, pretvarajući se u pozitivne ione. Ovo svojstvo atoma metala određeno je da imaju relativno velike radijuse i mali broj elektrona(uglavnom 1 do 3 na vanjskom sloju). Jedina iznimka je 6 metala: atomi germanija, kositra i olova na vanjskom sloju imaju 4 elektrona, atomi antimona i bizmuta - 5, atomi polonija - 6. Za atome metala karakteriziraju male vrijednosti elektronegativnosti(od 0,7 do 1,9) i isključivo restorativna svojstva, tj. sposobnost davanja elektrona. U periodnom sustavu kemijskih elemenata D. I. Mendeljejeva metali se nalaze ispod dijagonale bor-astat, kao i iznad nje, u sekundarnim podskupinama. U periodama i glavnim podskupinama poznati su obrasci u promjenama metalnih, a time i redukcijskih svojstava atoma elemenata.
Kemijski elementi koji se nalaze blizu dijagonale bor-astatin (Be, Al, Ti, Ge, Nb, Sb, itd.) imaju dvostruka svojstva: u nekim svojim spojevima ponašaju se kao metali, u drugima pokazuju svojstva nemetala. U sekundarnim podskupinama redukcijska svojstva metala najčešće opadaju s povećanjem atomskog broja.
Usporedite aktivnost vama poznatih metala I. skupine sekundarne podskupine: Cu, Ag, Au; II grupa sekundarne podskupine: Zn, Cd, Hg - i to ćete vidjeti sami. To se može objasniti činjenicom da je jakost veze između valentnih elektrona i jezgre u atomima ovih metala u velikoj mjeri pod utjecajem veličine nuklearnog naboja, a ne polumjera atoma. Naboj jezgre značajno se povećava, a privlačenje elektrona prema jezgri se povećava. U ovom slučaju, iako se atomski radijus povećava, on nije toliko značajan kao za metale glavnih podskupina.
Jednostavne tvari koje čine kemijski elementi - metali i složene tvari koje sadrže metale igraju vitalnu ulogu u mineralnom i organskom "životu" Zemlje. Dovoljno je zapamtiti da su atomi (ioni) metalnih elemenata sastavni dio spojevi koji određuju metabolizam u ljudskom tijelu i životinjama. Na primjer, 76 elemenata nalazi se u ljudskoj krvi, a samo 14 od njih nisu metali.
U ljudskom tijelu neki metalni elementi (kalcij, kalij, natrij, magnezij) prisutni su u velikim količinama, tj. oni su makroelementi. A metali poput kroma, mangana, željeza, kobalta, bakra, cinka, molibdena prisutni su u malim količinama, tj. to su elementi u tragovima. Ako osoba ima 70 kg, tada njegovo tijelo sadrži (u gramima): kalcij - 1700, kalij - 250, natrij - 70, magnezij - 42, željezo - 5, cink - 3. Svi metali su izuzetno važni, javljaju se zdravstveni problemi i s njihovim nedostatkom i s njihovim viškom.
Na primjer, ioni natrija reguliraju sadržaj vode u tijelu i prijenos živčanih impulsa. Njegov nedostatak dovodi do glavobolja, slabosti, lošeg pamćenja, gubitka apetita, a višak do povišenog krvnog tlaka, hipertenzije i bolesti srca.
Jednostavne tvari – metali
Pojava civilizacije (brončano doba, željezno doba) povezana je s razvojem proizvodnje metala (jednostavnih tvari) i legura. Znanstvena i tehnološka revolucija koja je započela prije otprilike 100 godina, zahvativši i industriju i društvenu sferu, također je usko povezana s proizvodnjom metala. Na temelju volframa, molibdena, titana i drugih metala, počeli su stvarati otporne na koroziju, super-tvrde, vatrostalne legure, čija je uporaba uvelike proširila mogućnosti strojarstva. U nuklearnoj i svemirskoj tehnologiji legure volframa i renija koriste se za izradu dijelova koji rade na temperaturama do 3000 °C; koristi se u medicini kirurški instrumenti od legura tantala i platine, jedinstvena keramika na bazi oksida titana i cirkonija.
I, naravno, ne smijemo zaboraviti da većina legura koristi dugo poznato metalno željezo, a osnova mnogih lakih legura sastoji se od relativno "mladih" metala - aluminija i magnezija. Kompozitni materijali postali su supernove, predstavljajući, na primjer, polimer ili keramiku, koji su iznutra (poput betona sa željeznim šipkama) ojačani metalnim vlaknima od volframa, molibdena, čelika i drugih metala i legura - sve ovisi o postavljenom cilju i svojstva materijala potrebnih za njegovo postizanje. Na slici je prikazan dijagram kristalne rešetke metalnog natrija. U njemu je svaki atom natrija okružen s osam susjeda. Atom natrija, kao i svi metali, ima mnogo praznih valentnih orbitala i malo valentnih elektrona. Elektronska formula atoma natrija: 1s 2 2s 2 2p 6 3s 1 3p 0 3d 0, gdje 3s, 3p, 3d - valentne orbitale.
Jednostruki valentni elektron atoma natrija 3s 1 mogu zauzeti bilo koju od devet slobodnih orbitala - 3s (jedan), 3p (tri) i 3d (pet), jer se ne razlikuju mnogo u energetskoj razini. Kada se atomi približavaju jedni drugima, kada se formira kristalna rešetka, valentne orbitale susjednih atoma se preklapaju, zbog čega se elektroni slobodno kreću od jedne do druge orbitale, uspostavljajući veze između svih atoma metalnog kristala. Takva kemijska veza naziva se metalna.
Metalnu vezu tvore elementi čiji atomi u vanjskom sloju imaju malo valentnih elektrona u usporedbi s velikim brojem vanjskih orbitala koje su energetski bliske. Njihovi valentni elektroni slabo se drže u atomu. Elektroni koji provode komunikaciju su socijalizirani i kreću se kroz kristalnu rešetku općenito neutralnog metala. Tvari sa metalna veza inherentne metalne kristalne rešetke, koje se obično shematski prikazuju kao što je prikazano na slici. Kationi i atomi metala smješteni na mjestima kristalne rešetke osiguravaju njenu stabilnost i čvrstoću (socijalizirani elektroni prikazani su kao male crne kuglice).

Metalni spoj- ovo je veza u metalima i legurama između metalnih atoma smještenih u čvorovima kristalne rešetke, koju provode zajednički valentni elektroni. Neki metali kristaliziraju u dva ili više kristalnih oblika. Ovo svojstvo tvari - da postoje u nekoliko kristalnih modifikacija - naziva se polimorfizam. Polimorfizam jednostavnih tvari poznat je kao alotropija. Na primjer, željezo ima četiri kristalne modifikacije, od kojih je svaka stabilna u određenom temperaturnom rasponu:
α - stabilan do 768 °C, feromagnetski;
β - stabilan od 768 do 910 °C, neferomagnetičan, tj. paramagnetičan;
γ - stabilan od 910 do 1390 °C, neferomagnetičan, tj. paramagnetičan;
δ - postojan od 1390 do 1539 °C (£° pl željezo), neferomagnetičan.
Kositar ima dvije kristalne modifikacije:
α - stabilan ispod 13,2 °C (p = 5,75 g/cm3). Ovo je sivi lim. Ima kristalnu rešetku tipa dijamanta (atomsku);
β - stabilan iznad 13,2 °C (p = 6,55 g/cm3). Ovo je bijeli lim.
Bijeli kositar je srebrnobijeli, vrlo mekan metal. Kada se ohladi ispod 13,2 °C, mrvi se u sivi prah, budući da se tijekom prijelaza njegov specifični volumen značajno povećava. Ovaj fenomen nazvan je "kositrena kuga".
Naravno, posebna vrsta kemijske veze i vrsta kristalne rešetke metala moraju ih odrediti i objasniti fizička svojstva. Što su oni? To su metalni sjaj, duktilnost, visoka električna i toplinska vodljivost, povećanje električnog otpora s porastom temperature, kao i značajna svojstva kao što su gustoća, visoka tališta i vrelišta, tvrdoća i magnetska svojstva. Mehanički učinak na kristal s metalnom kristalnom rešetkom uzrokuje pomicanje slojeva ionskih atoma jedan u odnosu na drugi (slika 17), a budući da se elektroni kreću kroz kristal, ne dolazi do kidanja veze, stoga su metali karakterizirani većim plastičnost. Sličan učinak na čvrstu tvar s kovalentnim vezama (atomska kristalna rešetka) dovodi do kidanja kovalentnih veza. Pucanje veza u ionskoj rešetki dovodi do međusobnog odbijanja istonabijenih iona. Stoga su tvari s atomskom i ionskom kristalnom rešetkom krhke. Najduktilniji metali su Au, Ag, Sn, Pb, Zn. Lako se izvlače u žicu, mogu se kovati, prešati ili smotati u ploče. Na primjer, od zlata se može napraviti zlatna folija debljine 0,003 mm, a od 0,5 g ovog metala izvući nit duljine 1 km. Čak i živa, koja je tekuća na sobnoj temperaturi, niske temperature kada je čvrsta, postaje savitljiva, poput olova. Samo Bi i Mn nemaju plastičnost, oni su krti.
Zašto metali imaju karakterističan sjaj, a uz to su neprozirni?
Elektroni koji ispunjavaju međuatomski prostor reflektiraju svjetlosne zrake (a ne propuštaju ih poput stakla), a većina metala jednako raspršuje sve zrake vidljivog dijela spektra. Zbog toga imaju srebrnastobijelu odn siva boja. Stroncij, zlato i bakar apsorbiraju kratke valne duljine (blizu ljubičasta boja) i reflektiraju duge valove svjetlosnog spektra, stoga imaju svijetložutu, žutu i "bakrenu" boju. Iako nam se u praksi metal ne čini uvijek kao “lagano tijelo”. Prvo, njegova površina može oksidirati i izgubiti sjaj. Stoga se samorodni bakar pojavljuje kao zelenkasti kamen. A Drugo, a čisti metal možda neće sjajiti. Vrlo tanki listovi srebra i zlata imaju potpuno neočekivani izgled - imaju plavkasto-zelenu boju. A fini metalni prah izgleda tamnosivo, čak i crno. Najveću refleksivnost imaju srebro, aluminij i paladij. Koriste se u proizvodnji ogledala, uključujući reflektore.
Zašto metali imaju visoku električnu vodljivost i provode toplinu?
Kaotično kretanje elektrona u metalu pod utjecajem primijenjenih električni napon poprimaju usmjereno kretanje, tj. provode električnu struju. Kako se temperatura metala povećava, amplitude vibracija atoma i iona smještenih u čvorovima kristalne rešetke rastu. To otežava kretanje elektrona, a električna vodljivost metala opada. Na niskim temperaturama, oscilatorno gibanje, naprotiv, znatno se smanjuje, a električna vodljivost metala naglo raste. Blizu apsolutne nule, metali praktički nemaju otpor; većina metala pokazuje supravodljivost.
Treba napomenuti da nemetali sa električna provodljivost(na primjer, grafit), na niskim temperaturama, naprotiv, ne provode električnu struju zbog nedostatka slobodnih elektrona. I tek s povećanjem temperature i uništavanjem nekih kovalentnih veza počinje se povećavati njihova električna vodljivost. Najveću električnu vodljivost imaju srebro, bakar, kao i zlato i aluminij, a najmanju mangan, olovo i živa.
Najčešće se toplinska vodljivost metala mijenja po istom obrascu kao i električna vodljivost. To je zbog velike pokretljivosti slobodnih elektrona, koji, sudarajući se s vibrirajućim ionima i atomima, izmjenjuju energiju s njima. Temperatura je izjednačena u cijelom komadu metala.
Mehanička čvrstoća, gustoća, talište metala vrlo su različiti. Štoviše, s povećanjem broja elektrona koji povezuju ion-atome i smanjenjem međuatomske udaljenosti u kristalima, pokazatelji ovih svojstava rastu.
Tako, alkalijski metali(Li, K, Na, Rb, Cs), čiji atomi imaju jedan valentni elektron, mekan (rezati nožem), niske gustoće (litij je najlakši metal s p = 0,53 g/cm 3) i topi se na niskim temperaturama (na primjer, talište cezija je 29 ° C). Jedini metal koji je tekući u normalnim uvjetima je živa, koja ima talište od -38,9 °C. Kalcij, koji ima dva elektrona u vanjskoj energetskoj razini svojih atoma, puno je tvrđi i tali se na višoj temperaturi (842 °C). Još je izdržljivija kristalna rešetka koju čine skandijevi ioni, koji imaju tri valentna elektrona. Ali najjače kristalne rešetke, visoke gustoće i temperature taljenja opažene su u metalima sekundarnih podskupina V, VI, VII, VIII. To se objašnjava činjenicom da su metali bočnih podskupina, koji imaju nesparene valentne elektrone na d-podrazini, karakterizirani stvaranjem vrlo jakih kovalentnih veza između atoma, pored metalne, koju provode elektroni vanjskog sloj od s-orbitala.
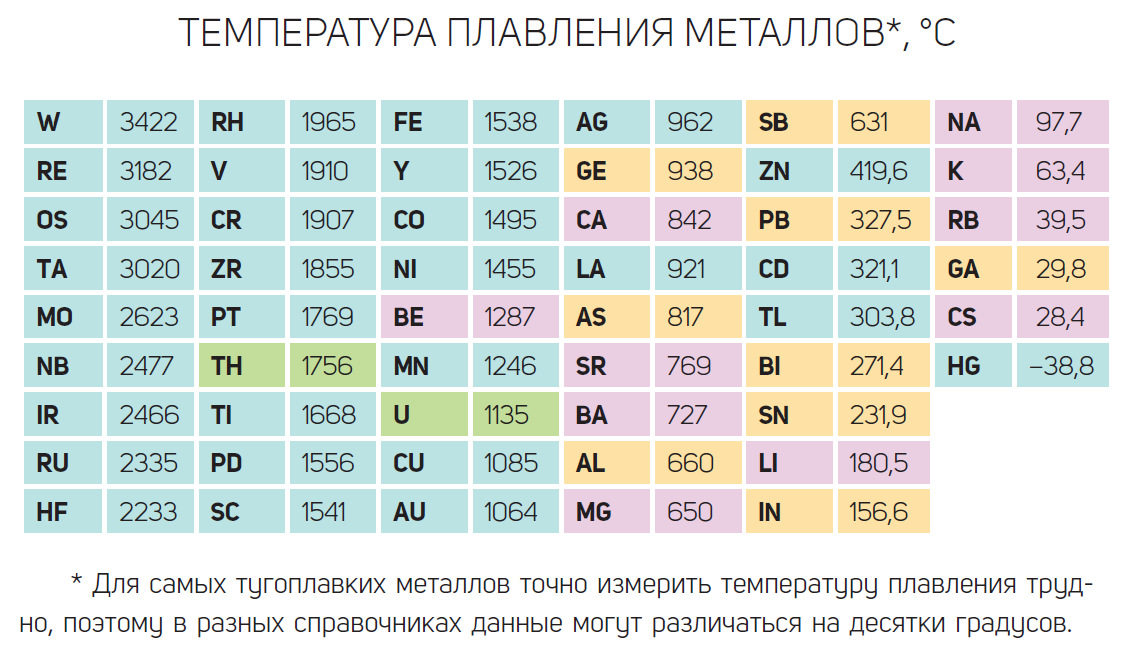
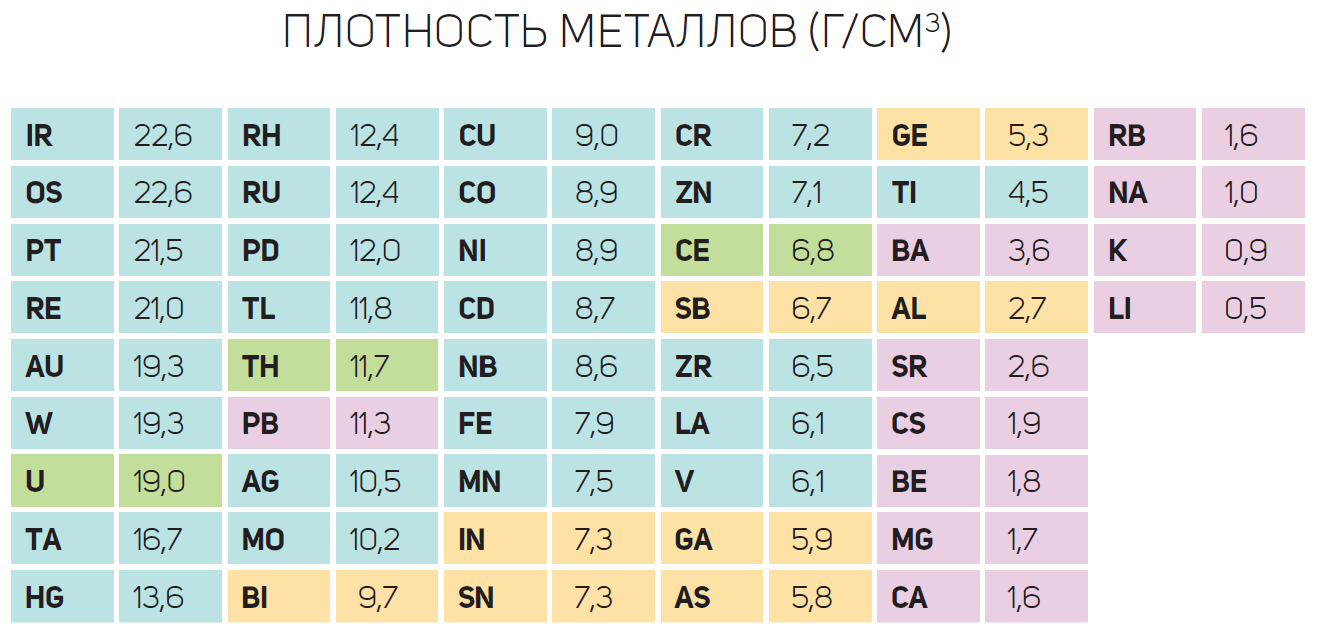
Najteži metal- ovo je osmij (Os) s p = 22,5 g / cm 3 (komponenta supertvrdih legura otpornih na habanje), najvatrostalniji metal je volfram W s t = 3420 ° C (koristi se za proizvodnju žarulje sa žarnom niti filamenti), najtvrđi metal je - Ovo je Cr krom (staklo za ogrebotine). Oni su dio materijala od kojih se izrađuju alati za rezanje metala, kočione pločice teških strojeva itd. Metali na različite načine stupaju u interakciju s magnetskim poljem. Metali kao što su željezo, kobalt, nikal i gadolinij ističu se svojom sposobnošću da budu jako magnetizirani. Zovu se feromagneti. Većina metala (alkalijski i zemnoalkalijski metali te značajan dio prijelaznih metala) su slabo magnetizirani i ne zadržavaju to stanje izvan magnetskog polja – oni su paramagnetici. Metali istisnuti magnetsko polje, - dijamagnetski materijali (bakar, srebro, zlato, bizmut).
Pri razmatranju elektronske strukture metala metale smo podijelili na metale glavne podskupine (s- i p-elementi) i metale sekundarne podskupine (prijelazni d- i f-elementi).
U tehnologiji je uobičajeno klasificirati metale prema različitim fizičkim svojstvima:
1. Gustoća - svjetlost (str< 5 г/см 3) и тяжелые (все остальные).
2. Talište - nisko talište i vatrostalno.
Postoje klasifikacije metala na temelju njihovih kemijskih svojstava. Metali niske kemijske aktivnosti nazivaju se plemenita(srebro, zlato, platina i njegovi analozi - osmij, iridij, rutenij, paladij, rodij). Na temelju sličnosti kemijskih svojstava razlikuju se alkalni(metali glavne podskupine grupe I), zemno alkalna(kalcij, stroncij, barij, radij), kao i metali rijetke zemlje(skandij, itrij, lantan i lantanidi, aktinijum i aktinidi).

Opća kemijska svojstva metala
Metalni atomi su relativno laki donirati valentne elektrone i prelaze u pozitivno nabijene ione, odnosno oksidiraju se. Ovo je glavno zajedničko svojstvo i atoma i jednostavnih tvari - metala. Metali su uvijek redukcijski agensi u kemijskim reakcijama. Reducirajuća sposobnost atoma jednostavnih tvari - metala formiranih od kemijskih elemenata jedne periode ili jedne glavne podskupine periodnog sustava D. I. Mendeljejeva prirodno se mijenja.
Redukcijska aktivnost metala u kemijskim reakcijama koje se odvijaju u vodenim otopinama odražava se njegovim položajem u nizu elektrokemijskih napona metala.

Na temelju ovog niza napona mogu se izvući sljedeći važni zaključci o kemijskoj aktivnosti metala u reakcijama koje se odvijaju u vodenim otopinama pod standardnim uvjetima (t = 25 °C, p = 1 atm).
· Što je metal dalje lijevo u ovom redu, to je moćniji redukcijski agens.
· Svaki metal je sposoban istisnuti (reducirati) iz soli u otopini one metale koji se nalaze iza njega u nizu naprezanja (desno).
· Metali smješteni u nizu napona lijevo od vodika sposobni su ga istisnuti iz kiselina u otopini
· Metali koji su najjači redukcijski agensi (alkalijski i zemnoalkalijski) reagiraju prvenstveno s vodom u bilo kojoj vodenoj otopini.
Redukcijska aktivnost metala, određena iz elektrokemijske serije, ne odgovara uvijek njegovom položaju u periodnom sustavu. To se objašnjava činjenicom da se pri određivanju položaja metala u nizu naprezanja uzima u obzir ne samo energija apstrakcije elektrona iz pojedinih atoma, već i energija utrošena na razaranje kristalne rešetke, kao i kao energija koja se oslobađa tijekom hidratacije iona. Na primjer, litij je aktivniji u vodenim otopinama od natrija (iako je Na po položaju u periodnom sustavu aktivniji metal). Činjenica je da je energija hidratacije Li + iona mnogo veća od energije hidratacije Na +, pa je prvi proces energetski povoljniji. Razmotrivši opće odredbe karakterizirajući redukcijska svojstva metala, prijeđimo na specifične kemijske reakcije.
Međudjelovanje metala s nemetalima
· Većina metala stvara okside s kisikom- osnovni i amfoterni. Kiseli oksidi prijelaznih metala, kao što je krom (VI) oksid CrOg ili mangan (VII) oksid Mn 2 O 7, ne nastaju izravnom oksidacijom metala s kisikom. Dobivaju se posredno.
Alkalijski metali Na, K aktivno reagiraju s kisikom u zraku, stvarajući perokside:
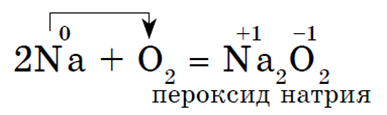
Natrijev oksid se dobiva neizravno kalciniranjem peroksida s odgovarajućim metalima:
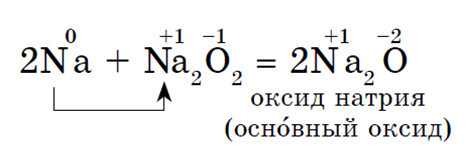
Litij i zemnoalkalijski metali reagiraju s atmosferskim kisikom, tvoreći bazične okside:

Ostali metali, osim metala zlata i platine, koji uopće nisu oksidirani atmosferskim kisikom, s njim djeluju manje aktivno ili kada se zagrijavaju:

· S halogenima metali tvore soli halogenovodičnih kiselina, Na primjer:

· Najaktivniji metali tvore hidride s vodikom- ionske soli slične tvari u kojima vodik ima oksidacijsko stanje -1, na primjer:

Mnogi prijelazni metali s vodikom tvore hidride posebne vrste - to je kao da se vodik otopi ili unese u kristalnu rešetku metala između atoma i iona, dok metal zadržava svoj izgled, ali povećava volumen. Apsorbirani vodik je u metalu, očito u atomskom obliku.
Postoje i intermedijarni metalni hidridi.
· Sivi metali stvaraju soli – sulfide, Na primjer:
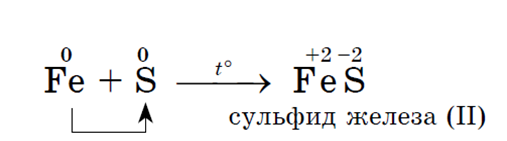
· Metali nešto teže reagiraju s dušikom, jer je kemijska veza u molekuli dušika N2 vrlo jaka; U tom slučaju nastaju nitridi. Na uobičajenim temperaturama samo litij reagira s dušikom:

Međudjelovanje metala sa složenim tvarima
· S vodom. U normalnim uvjetima alkalijski i zemnoalkalijski metali istiskuju vodik iz vode i tvore topljive baze - lužine, npr.
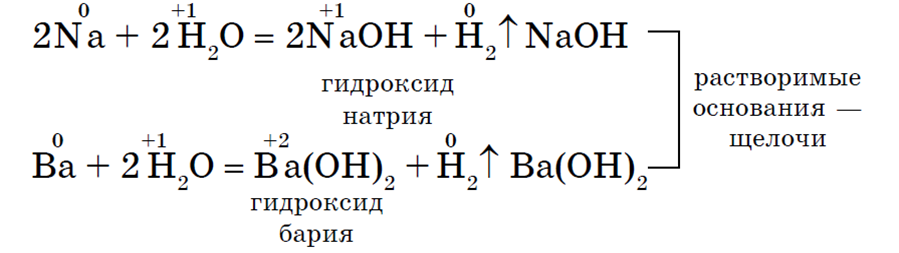
Drugi metali koji su u nizu napona prije vodika također mogu pod određenim uvjetima istisnuti vodik iz vode. Ali aluminij burno reagira s vodom samo ako se s njegove površine ukloni oksidni film:
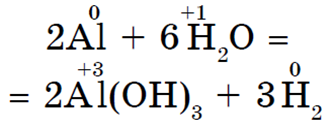
Magnezij reagira s vodom tek kad prokuha, a oslobađa se i vodik:
Ako se gorući magnezij doda vodi, izgaranje se nastavlja jer dolazi do reakcije:
Željezo reagira s vodom samo kada je vruće:
· S kiselinama u otopini (HCl, H 2 TAKO 4 ), CH 3 COOH i drugi, osim HNO 3 ) metali koji su u nizu napona do vodika međusobno djeluju. Ovo proizvodi sol i vodik.
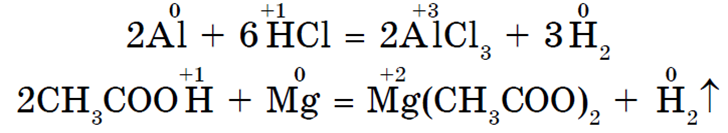
Ali olovo (i neki drugi metali), unatoč svom položaju u nizu napona (lijevo od vodika), gotovo je netopljivo u razrijeđenoj sumpornoj kiselini, budući da je nastali olovni sulfat PbSO 4 netopljiv i stvara zaštitni film na površini metala .
· Sa solima manje aktivnih metala u otopini. Kao rezultat ove reakcije nastaje sol aktivnijeg metala, a manje aktivan metal se oslobađa u slobodnom obliku.
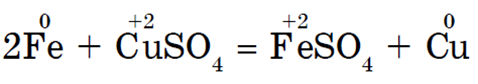
Mora se zapamtiti da se reakcija događa u slučajevima kada je nastala sol topljiva. Istiskivanje metala iz njihovih spojeva drugim metalima prvi je detaljno proučavao N. N. Beketov, veliki ruski fizikalno-kemijski znanstvenik. Rasporedio je metale prema njihovoj kemijskoj aktivnosti u "niz pomaka", koji je postao prototip niza metalnih naprezanja.
· S organskim tvarima. Interakcija s organskim kiselinama slična je reakcijama s mineralnim kiselinama. Alkoholi mogu pokazivati slaba kisela svojstva u interakciji s alkalnim metalima:
Fenol reagira slično:
Metali sudjeluju u reakcijama s haloalkanima, koji se koriste za dobivanje nižih cikloalkana i za sinteze tijekom kojih ugljični skelet molekule postaje složeniji (A. Wurtz reakcija):

· Metali čiji su hidroksidi amfoterni međusobno djeluju s alkalijama u otopini. Na primjer:
· Metali mogu međusobno tvoriti kemijske spojeve koji se zajednički nazivaju intermetalni spojevi. Oni najčešće ne pokazuju oksidacijska stanja atoma, koja su karakteristična za spojeve metala s nemetalima. Na primjer:
Cu 3 Au, LaNi 5, Na 2 Sb, Ca 3 Sb 2 itd.
Intermetalni spojevi obično nemaju stalan sastav, kemijska veza u njima je uglavnom metalna. Stvaranje ovih spojeva je tipičnije za metale sekundarnih podskupina.
Metali glavnih podskupina skupina I-III periodnog sustava kemijskih elemenata D. I. Mendeljejeva
opće karakteristike
To su metali glavne podskupine I. skupine. Njihovi atomi na vanjskoj energetskoj razini imaju po jedan elektron. Alkalijski metali - jaka redukcijska sredstva. Njihova redukcijska moć i kemijska aktivnost rastu s povećanjem atomskog broja elementa (tj. od vrha prema dolje u periodnom sustavu elemenata). Svi oni imaju elektronsku vodljivost. Snaga veze između atoma alkalijskih metala opada s povećanjem atomskog broja elementa. Također im se smanjuju talište i vrelište. Alkalijski metali reagiraju s mnogim jednostavnim tvarima - oksidirajuća sredstva. U reakcijama s vodom stvaraju u vodi topljive baze (lužine). Zemnoalkalijski elementi nazivaju se elementi glavne podskupine II. Atomi ovih elemenata sadrže na vanjskoj energetskoj razini po dva elektrona. Oni su najjača redukcijska sredstva, imaju oksidacijsko stanje +2. U ovoj glavnoj podskupini uočavaju se opći obrasci promjena fizikalnih i kemijskih svojstava, povezani s povećanjem veličine atoma u skupini odozgo prema dolje, a kemijska veza između atoma također slabi. Kako se veličina iona povećava, kisela svojstva oksida i hidroksida postaju slabija, a bazična se povećavaju.
Glavnu podskupinu III skupine čine elementi bor, aluminij, galij, indij i talij. Svi elementi su p-elementi. Na vanjskoj energetskoj razini imaju tri 2 str 1 ) elektron, što objašnjava sličnost svojstava. Oksidacijsko stanje +3. Unutar skupine, kako se nuklearni naboj povećava, metalna svojstva se povećavaju. Bor je nemetalni element, dok aluminij već ima metalna svojstva. Svi elementi tvore okside i hidrokside.
Većina metala nalazi se u podskupinama periodnog sustava elemenata. Za razliku od elemenata glavnih podskupina, gdje se vanjska razina atomskih orbitala postupno ispunjava elektronima, u elementima sekundarnih podskupina popunjavaju se d-orbitale pretposljednje energetske razine i s-orbitale posljednje. Broj elektrona odgovara broju grupe. Elementi s jednakim brojem valentnih elektrona grupirani su pod istim brojem. Svi elementi podskupina su metali.
Jednostavne tvari sastavljene od metala podskupine imaju jake kristalne rešetke koje su otporne na toplinu. Ovi metali su najčvršći i najvatrostalniji među ostalim metalima. Kod d-elemenata jasno je vidljiv prijelaz s porastom njihove valencije od bazičnih svojstava preko amfoternih do kiselih.
Alkalijski metali (Na, K)
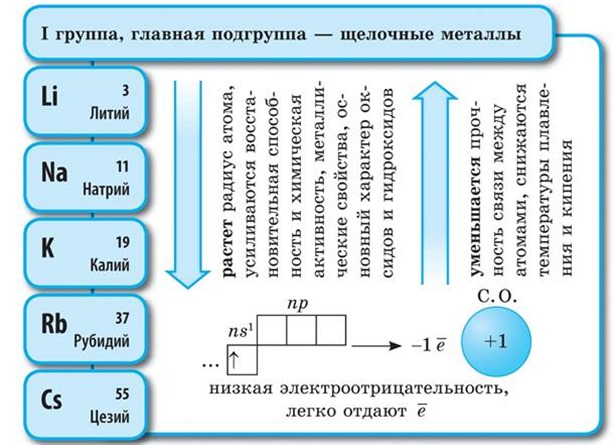
Na vanjskoj energetskoj razini atomi alkalijskih metala elemenata sadrže po jedan elektron, koji se nalazi na velikoj udaljenosti od jezgre. Oni lako odustaju od ovog elektrona, pa su jaki redukcijski agensi. U svim spojevima, alkalijski metali pokazuju oksidacijsko stanje +1. Njihova redukcijska svojstva rastu s povećanjem atomskog radijusa od Li do Cs. Svi su tipični metali, srebrno-bijele su boje, mekani (mogu se rezati nožem), lagani i topljivi. Aktivno komunicirajte sa svima nemetali:
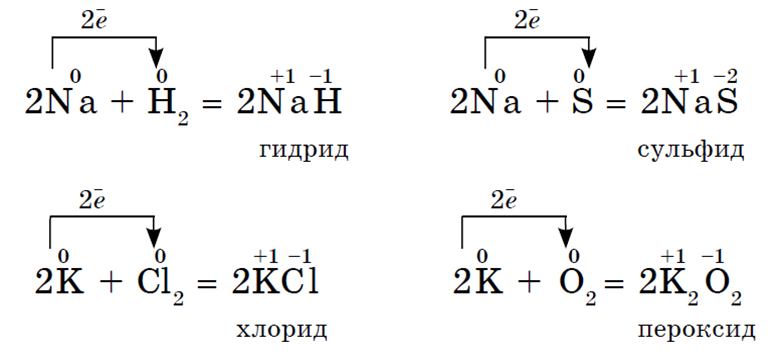
Svi alkalijski metali u reakciji s kisikom (osim Li) tvore perokside. Alkalijski metali se ne nalaze u slobodnom obliku zbog svoje visoke kemijske reaktivnosti.
Oksidi- čvrste tvari s osnovnim svojstvima. Dobivaju se kalciniranjem peroksida s odgovarajućim metalima:
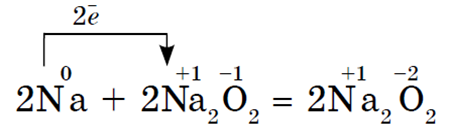
Hidroksidi NaOH, KOH- krute bijele tvari, higroskopne, topljive u vodi uz oslobađanje topline, svrstavaju se u lužine:

Soli alkalnih metala gotovo su sve topive u vodi. Najvažniji od njih: Na 2 CO 3 - natrijev karbonat; Na 2 CO 3 10H 2 O - kristalna soda; NaHCO 3 - natrijev bikarbonat, soda bikarbona; K 2 CO 3 - kalijev karbonat, potaša; Na 2 SO 4 10H 2 O - Glauberova sol; NaCl - natrijev klorid, kuhinjska sol.
Elementi I. skupine u tablicama



Zemnoalkalijski metali (Ca, Mg)

Kalcij (Ca) je predstavnik zemnoalkalijski metali, što su nazivi elemenata glavne podskupine II skupine, ali ne svih, već samo počevši od kalcija pa nizbrdo. To su kemijski elementi koji u interakciji s vodom stvaraju lužine. Kalcij na vanjskoj energetskoj razini sadrži dva elektrona, oksidacijsko stanje +2.
Fizikalna i kemijska svojstva kalcija i njegovih spojeva prikazana su u tablici.

magnezij (Mg) ima istu atomsku strukturu kao kalcij, njegovo oksidacijsko stanje je također +2. Mekani metal, ali njegova površina postaje prekrivena zrakom zaštitni film, što malo smanjuje kemijsku aktivnost. Njegovo izgaranje prati zasljepljujući bljesak. MgO i Mg(OH) 2 pokazuju osnovna svojstva. Iako je Mg(OH) 2 slabo topljiv, oboji otopinu fenolftaleina u grimizno.
Mg + O 2 = MgO 2
MO oksidi su tvrde, bijele, vatrostalne tvari. U tehnici se CaO naziva Ne gašeno vapno, i MgO - spaljeni magnezij, ti se oksidi koriste u proizvodnji građevinskih materijala. Reakcija kalcijeva oksida s vodom praćena je oslobađanjem topline i naziva se gašenje vapna, a nastali Ca(OH) 2 naziva se gašeno vapno. Prozirna otopina kalcijeva hidroksida naziva se vapnena voda, a bijela suspenzija Ca(OH) 2 u vodi vapneno mlijeko.
Magnezijeve i kalcijeve soli dobivaju se reakcijom s kiselinama.
CaCO 3 - kalcijev karbonat, kreda, mramor, vapnenac. Koristi se u građevinarstvu. MgCO 3 – magnezijev karbonat – koristi se u metalurgiji za uklanjanje troske.
CaSO 4 2H 2 O - gips. MgSO 4 - magnezijev sulfat - naziva se gorka, ili engleska sol, nalazi se u morskoj vodi. BaSO 4 - barijev sulfat - zbog svoje netopljivosti i sposobnosti blokiranja rendgenskih zraka koristi se u dijagnostici (“baritna kaša”) gastrointestinalnog trakta.
Kalcij čini 1,5% tjelesne težine čovjeka, 98% kalcija nalazi se u kostima. Magnezij je bioelement, u ljudskom tijelu ima ga oko 40 g, sudjeluje u stvaranju proteinskih molekula.
Zemnoalkalijski metali u tablicama




Aluminij
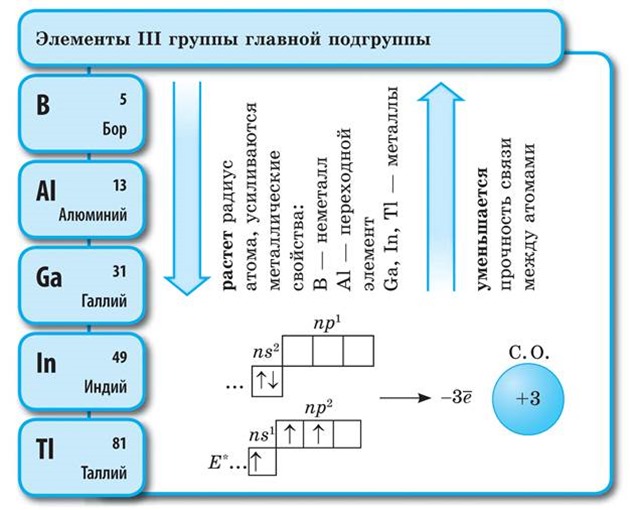
Aluminij (Al)- element glavne podskupine III skupine periodnog sustava D.I. Mendelejeva. Atom aluminija sadrži na vanjskoj energetskoj razini tri elektrona, koje lako oslobađa tijekom kemijskih interakcija. Predak podskupine i gornji susjed aluminija - bor - ima manji atomski radijus (za bor je 0,080 nm, za aluminij - 0,143 nm). Osim toga, atom aluminija ima jedan međusloj od osam elektrona (2e; 8e; 3e), koji sprječava vanjske elektrone da dođu do jezgre. Stoga su redukcijska svojstva atoma aluminija dosta izražena.
U gotovo svim svojim spojevima aluminij ima oksidacijsko stanje +3.
Aluminij je jednostavna tvar
Srebrno-bijeli svijetli metal. Topi se na 660 °C. Vrlo je plastičan, lako se izvlači u žicu i smota u foliju debljine do 0,01 mm. Ima vrlo visoku električnu i toplinsku vodljivost. Oni tvore lake i čvrste legure s drugim metalima. Aluminij je vrlo aktivan metal. Ako je aluminijski prah ili fini aluminijska folija previše zagrijati, onda oni zapaliti i gorjeti zasljepljujućim plamenom:
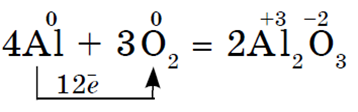
Ova reakcija se može primijetiti kada gore prskalice i vatromet. Aluminij, kao i svi metali, Lako reagira s nemetalima, posebno u obliku praha. Da bi reakcija započela, potrebno je početno zagrijavanje, osim reakcija s halogenima - klorom i bromom, ali tada sve reakcije aluminija s nemetalima teku vrlo burno i praćene su oslobađanjem velike količine topline. :

Aluminij dobro se otapa u razrijeđenoj sumpornoj i solnoj kiselini:

I ovdje koncentrirana sumporna i dušična kiselina pasiviraju aluminij, formirajući se na metalnoj površini gusti izdržljivi oksidni film, što sprječava daljnji tijek reakcije. Stoga se te kiseline prevoze u aluminijskim cisternama.
Aluminijev oksid i hidroksid imaju amfoterna svojstva, stoga se aluminij otapa u vodenim otopinama lužina, tvoreći soli - aluminate:
Aluminij se široko koristi u metalurgiji za proizvodnju metala - kroma, mangana, vanadija, titana, cirkonija iz njihovih oksida. Ova metoda se naziva aluminotermija. U praksi se često koristi termit - mješavina Fe 3 O 4 s aluminijskim prahom. Ako se ova smjesa zapali, na primjer, pomoću magnezijske trake, tada dolazi do snažne reakcije, oslobađajući velika količina toplina:
Oslobođena toplina sasvim je dovoljna da se nastalo željezo potpuno otopi, pa se ovaj postupak koristi za zavarivanje čeličnih proizvoda.
Aluminij se može dobiti elektrolizom - razgradnjom taline njegovog oksida Al 2 O 3 na sastavne dijelove pomoću električna struja. Ali talište aluminijevog oksida je oko 2050 °C, tako da elektroliza zahtijeva velike količine energije.
Aluminijski priključci
Aluminosilikati. Ovi se spojevi mogu smatrati solima nastalim oksidom aluminija, silicija, alkalijskih i zemnoalkalijskih metala. Oni čine najveći dio zemljine kore. Konkretno, aluminosilikati su dio feldspata, najčešćih minerala i glina.
Boksit- stijena iz koje se dobiva aluminij. Sadrži aluminijev oksid Al 2 O 3.
Korund- mineral sastava Al 2 O 3, ima vrlo visoku tvrdoću, njegova fino zrnata sorta koja sadrži nečistoće - šmirgl, koristi se kao abrazivni (brusni) materijal. Drugi prirodni spoj, glinica, ima istu formulu.
Poznati su prozirni, nečistoćama obojeni kristali korunda: crveni - rubini i plavi - safiri, koji se koriste kao drago kamenje. Trenutno se dobivaju umjetno i koriste se ne samo za nakit, već i za tehničke svrhe, na primjer, za proizvodnju dijelova za satove i druge precizne instrumente. Kristali rubina koriste se u laserima.
Aluminijev oksid Al 2 O 3 - bijela tvar s vrlo visokim talištem. Može se dobiti razgradnjom aluminijevog hidroksida zagrijavanjem:
Aluminijev hidroksid Al(OH) 3 taloži se u obliku želatinoznog taloga pod djelovanjem lužina na otopine aluminijevih soli:
Kako amfoterni hidroksid lako se otapa u otopinama kiselina i lužina:

Aluminati nazivaju se soli nestabilnih aluminijevih kiselina - ortoaluminij H 2 AlO 3, metaaluminij HAlO 2 (može se smatrati ortoaluminijevom kiselinom iz čije je molekule uklonjena molekula vode). Prirodni aluminati uključuju plemeniti spinel i dragocjeni krizoberil. Aluminijeve soli, osim fosfata, vrlo su topive u vodi. Neke soli (sulfidi, sulfiti) se razgrađuju vodom. Aluminijev klorid AlCl 3 koristi se kao katalizator u proizvodnji mnogih organskih tvari.
Elementi grupe III u tablicama




Karakteristike prijelaznih elemenata - bakar, cink, krom, željezo

Bakar (Cu)- element sekundarne podskupine prve skupine. Elektronička formula: (…3d 10 4s 1). Njegov deseti d-elektron je pokretan, jer je prešao s podrazine 4S. Bakar u spojevima pokazuje oksidacijska stanja +1 (Cu 2 O) i +2 (CuO). Bakar je svijetloružičasti metal, kovak, viskozan i izvrstan vodič električne energije. Talište 1083 °C.

Kao i drugi metali podskupine I skupine I periodnog sustava, bakar stoji desno od vodika u nizu aktivnosti i ne istiskuje ga iz kiselina, već reagira s oksidirajućim kiselinama:

Pod utjecajem lužina na otopine bakrenih soli taloži se talog slabe baze plave boje.- bakrov (II) hidroksid, koji se zagrijavanjem razlaže na bazični crni oksid CuO i vodu:

Kemijska svojstva bakra u tablicama



cink (Zn)- element sekundarne podskupine skupine II. Njegovo elektronska formula sljedeće: (...3d 10 4s 2). Budući da je predzadnja d-podrazina u atomima cinka potpuno potpuna, cink u spojevima pokazuje oksidacijsko stanje +2.
Cink je srebrnobijeli metal koji se praktički ne mijenja na zraku. Otporan je na koroziju zbog prisutnosti oksidnog filma na svojoj površini. Cink je jedan od najaktivnijih metala na povišenim temperaturama reagira s jednostavnim tvarima:

Cink, kao i drugi metali, istiskuje manje aktivnih metala iz njihovih soli:
Zn + 2AgNO 3 = 2Ag + Zn(NO 3) 2
Cink hidroksid je amfoteran, tj. pokazuje svojstva i kiselina i baza. Kada se otopina lužine postupno dodaje otopini cinkove soli, talog koji je prvobitno nastao se otapa (isto se događa s aluminijem):

Kemijska svojstva cinka u tablicama



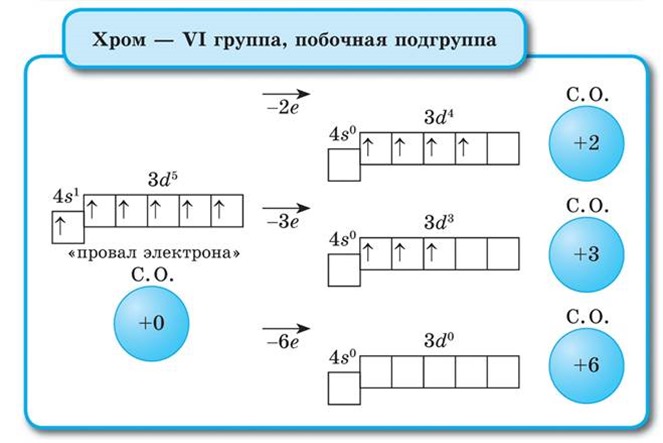
Na primjer krom (Cr) može se pokazati da svojstva prijelaznih elemenata ne mijenjaju se bitno tijekom perioda: Do kvantitativne promjene dolazi zbog promjene broja elektrona u valentnim orbitalama. Maksimalno oksidacijsko stanje kroma je +6. Metal u seriji aktivnosti nalazi se lijevo od vodika i istiskuje ga iz kiselina:
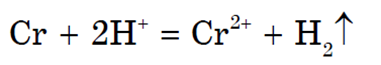
Kada se takvoj otopini doda otopina lužine, nastaje talog Me(OH). 2 , koji se brzo oksidira atmosferskim kisikom:
Odgovara amfoternom oksidu Cr 2 O 3. Kromov oksid i hidroksid (u najvišem oksidacijskom stanju) pokazuju svojstva kiselih oksida, odnosno kiselina. Soli kromne kiseline (H 2 CrO 4 ) u kiseloj sredini prelaze u dikromate- soli dikromne kiseline (H 2 Cr 2 O 7). Spojevi kroma imaju visoku oksidacijsku sposobnost.
Kemijska svojstva kroma u tablicama

Željezo Fe- element sekundarne podskupine VIII skupine i 4. razdoblja periodnog sustava D. I. Mendelejeva. Atomi željeza su strukturirani nešto drugačije od atoma elemenata glavnih podskupina. Kao što i priliči elementu 4. perioda, atomi željeza imaju četiri energetske razine, ali nije popunjena zadnja, već pretposljednja, treća razina od jezgre. Na posljednjoj razini atomi željeza sadrže dva elektrona. Na pretposljednjoj razini, koja može primiti 18 elektrona, atom željeza ima 14 elektrona. Posljedično, distribucija elektrona po razinama u atomima željeza je sljedeća: 2e; 8e ; 14e; 2e. Kao i svi metali, atomi željeza pokazuju redukcijska svojstva, odajući tijekom kemijskih interakcija ne samo dva elektrona s posljednje razine i stječući oksidacijsko stanje +2, već i elektron s pretposljednje razine, dok se oksidacijsko stanje atoma povećava na +3.
Željezo je jednostavna tvar
To je srebrno-bijeli sjajni metal s talištem od 1539 °C. Vrlo je plastičan, stoga ga je lako obrađivati, kovati, valjati, štancati. Željezo ima sposobnost magnetiziranja i demagnetiziranja. Može mu se dati veća čvrstoća i tvrdoća toplinskim i mehaničkim metodama. Postoji tehnički čisto i kemijski čisto željezo. Tehnički čisto željezo je u biti niskougljični čelik, sadrži 0,02-0,04% ugljika, a još manje kisika, sumpora, dušika i fosfora. Kemijski čisto željezo sadrži manje od 0,01% nečistoća. Od tehnički čistog željeza, npr. Spajalice i gumbi. Takvo željezo lako korodira, dok kemijski čisto željezo gotovo nije podložno koroziji. Danas je željezo temelj moderne tehnologije i poljoprivredne tehnike, prometa i komunikacija, svemirski brodovi i općenito cijele moderne civilizacije. Većina proizvoda, od igle za šivanje do svemirske letjelice, ne može se izraditi bez upotrebe željeza.
Kemijska svojstva željeza
Željezo može pokazivati oksidacijska stanja +2 i +3, prema tome, željezo daje dvije serije spojeva. Broj elektrona koje atom željeza preda tijekom kemijskih reakcija ovisi o oksidacijskoj sposobnosti tvari koje s njim reagiraju.
Na primjer, s halogenima, željezo stvara halogenide, u kojima ima oksidacijski stupanj +3:

a sa sumporom - željezo (II) sulfid:
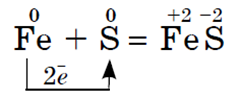
Vruće željezo gori u kisiku uz stvaranje kamenca željeza:

Na visokim temperaturama (700-900 °C) željezo reagira s vodenom parom:
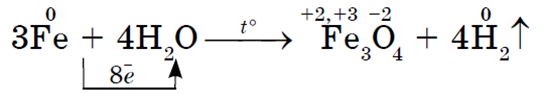
U skladu s položajem željeza u elektrokemijskom nizu napona, ono može istisnuti metale desno od sebe iz vodene otopine njihove soli, na primjer:

Željezo se otapa u razrijeđenoj solnoj i sumpornoj kiselini, tj. oksidira se vodikovim ionima:

Željezo se otapa i u razrijeđenoj dušičnoj kiselini., pritom nastaje željezov (III) nitrat, voda i produkti redukcije dušične kiseline - N 2, NO ili NH 3 (NH 4 NO 3) ovisno o koncentraciji kiseline.
Spojevi željeza
U prirodi željezo tvori brojne minerale. Ovo je magnetska željezna ruda (magnetit) Fe 3 O 4, crvena željezna ruda (hematit) Fe 2 O 3, smeđa željezna ruda (limonit) 2Fe 2 O 3 3H 2 O. Drugi prirodni spoj željeza je željezo ili sumpor, pirit ( pirit) FeS 2, ne služi kao željezna ruda za proizvodnju metala, već se koristi za proizvodnju sumporne kiseline.
Željezo karakteriziraju dva niza spojeva: željezo(II) i spojevi željeza(III).Željezov (II) oksid FeO i njegov odgovarajući željezov (II) hidroksid Fe(OH) 2 dobivaju se neizravno, posebno kroz sljedeći lanac transformacija:
Oba spoja imaju različita osnovna svojstva.
Željezo(II) kationi Fe 2 + lako se oksidira atmosferskim kisikom u katione željeza (III) Fe 3 + . Zbog toga bijeli talog željezovog (II) hidroksida postaje zelen, a zatim postaje smeđi, pretvarajući se u željezov (III) hidroksid:
Željezov(III) oksid Fe 2 O 3 a odgovarajući željezov (III) hidroksid Fe(OH) 3 također se dobiva neizravno, na primjer, duž lanca:
Od soli željeza najveće tehničko značenje imaju sulfati i kloridi.
Kristalni hidrat željeznog (II) sulfata FeSO 4 7H 2 O, poznat kao željezni sulfat, koristi se za suzbijanje biljnih štetnika, za pripremu mineralne boje i u druge svrhe. Željezo (III) klorid FeCl 3 koristi se kao sredstvo za jedkanje pri bojanju tkanina. Željezo (III) sulfat Fe 2 (SO 4) 3 9H 2 O koristi se za pročišćavanje vode i druge svrhe.
Fizička i kemijska svojstva željeza i njegovih spojeva sažeta su u tablici:

Kemijska svojstva željeza u tablicama

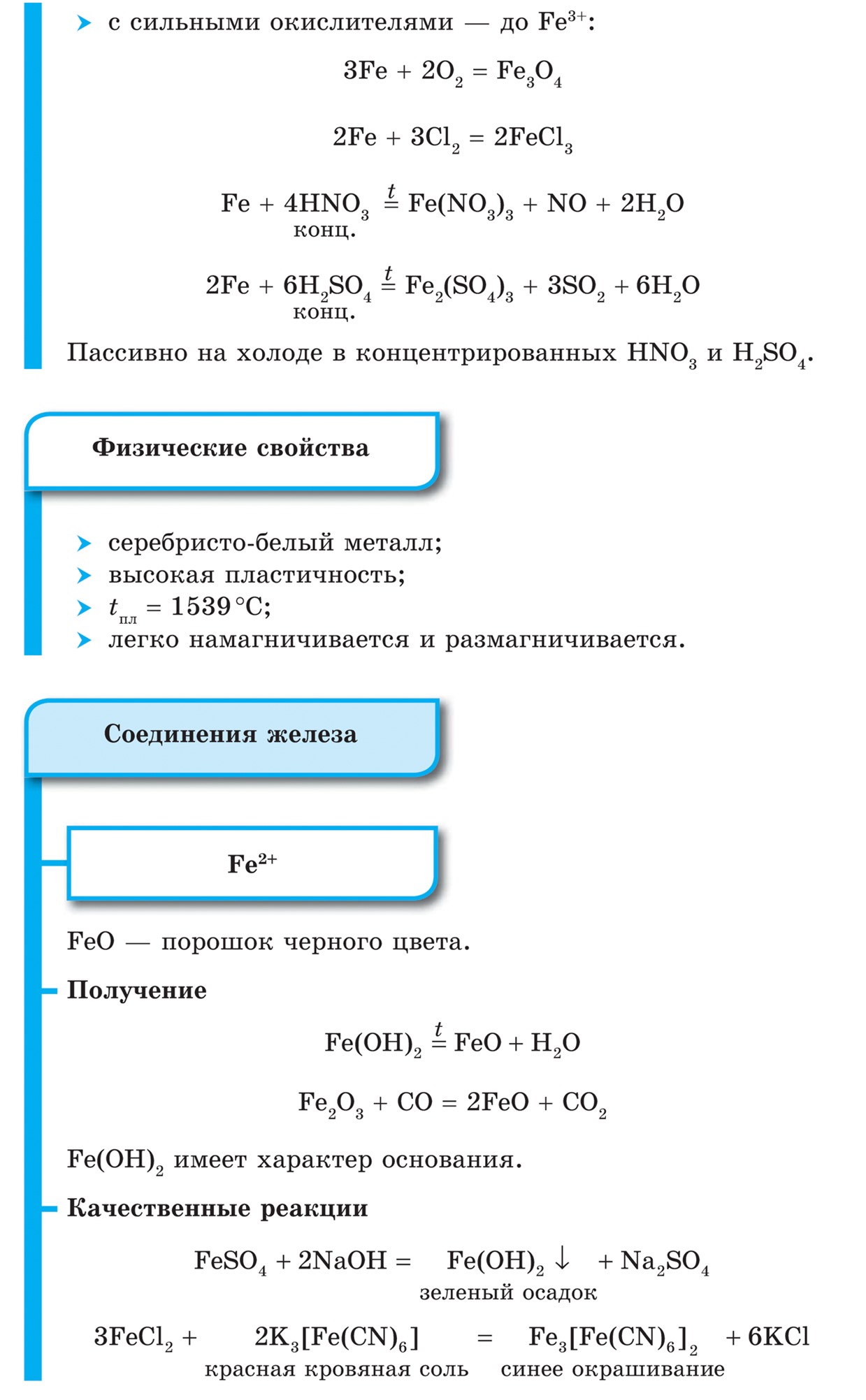

Kvalitativne reakcije na ione Fe 2+ i Fe 3+
Za prepoznavanje spojeva željeza (II) i (III). provode kvalitativne reakcije na Fe ione 2+ i Fe 3+ . Kvalitativna reakcija na ione Fe 2+ je reakcija soli željeza (II) sa spojem K 3, koji se naziva crvena krvna sol. Riječ je o posebnoj skupini soli koje nazivamo kompleksnim solima, s kojima ćete se kasnije upoznati. U međuvremenu morate razumjeti kako se takve soli disociraju:
Reagens za Fe 3+ ione je još jedan složeni spoj - žuta krvna sol - K 4, koja u otopini disocira na sličan način:
Ako se otopine koje sadrže ione Fe 2+ i Fe 3+ dodaju otopinama crvene krvne soli (reagens za Fe 2+) i žute krvne soli (reagens za Fe 3+), tada se u oba slučaja taloži isti plavi talog. :
Za detekciju Fe 3+ iona također se koristi interakcija soli željeza (III) s kalijevim tiocijanatom KNCS ili amonijevim tiocijanatom NH 4 NCS. U tom slučaju nastaje jarko obojen FeNCNS 2+ ion, zbog čega cijela otopina poprima intenzivno crvenu boju:
Tablica topljivosti
Od 109 kemijskih elemenata periodnog sustava Dmitrija Ivanoviča Mendeljejeva, 87 elemenata tvori jednostavne tvari s metalnom vezom u slobodnom stanju.
Još u davnim vremenima ljudi su obraćali pozornost na posebna svojstva metala: mogu se topiti, a zatim im se može dati bilo koji oblik, izrađujući vrhove kopalja i strijela, sjekire i mačeve, posuđe, pa čak i plugove. Kao što znamo iz povijesti, kameno doba zamijenilo je bakreno, zatim brončano, a još kasnije željezno doba. Apsolutno svi metali, osim žive, u svom normalnom stanju su čvrste tvari s određenim skupom općih svojstava. Metali su plastične, kovke, viskozne tvari koje imaju metalni sjaj, kao i sposobnost provođenja električne struje i topline.
U davna vremena metalima su se pripisivala razna čudesna svojstva. U Drevni Egipt smatralo se da sedam metala predstavlja sedam planeta na Zemlji.
Naši preci su tako plemeniti metal kao što je zlato personificirali sa Suncem, srebro sa Mjesecom, bakar sa Venerom, željezo sa Marsom, kositar sa Jupiterom, olovo sa Saturnom, živu sa Merkurom. Čini se da je količina metala koju su ljudi u to vrijeme poznavali samo potvrđivala takav odnos između planeta i metala. Kad su alkemičari u šesnaestom stoljeću uspjeli otkriti metalni antimon, dugo ga nisu htjeli prepoznati kao metal - uostalom, za antimon nije bilo dovoljno određenog planeta na nebu.
M.V. Lomonosov je opisao metale kao "lagano tijelo koje se može kovati", pripisao je to svojstvo zlatu, srebru, bakru, kositru, željezu i olovu. A. Lavuzier je u svojoj knjizi "Osnovni tečaj kemije" napisanoj 1789. godine spomenuo oko sedamnaest metala. Početkom devetnaestog stoljeća došlo je do otkrića metala platine. Danas je broj metala poznatih čovjeku dostigao 87.
Plastičnost je jedno od najvažnijih svojstava metala, koje im omogućuje promjenu oblika pri udaru, spljoštenje u tanke ploče ili rastezanje u žicu. Stoga mobilni socijalizirani elektroni ublažavaju kretanje pozitivnih iona, štiteći ih jedne od drugih. Zato se obrada metala pri promjeni oblika odvija bez njegovog razaranja.
Zlato se po svojoj plastičnosti razlikuje od plemenitih metala. Od samo jednog grama zlata može se napraviti tri kilometra žice.
Prisutnost socijaliziranih elektrona također objašnjava tako karakteristično svojstvo metala kao što je njihova električna vodljivost. Čak je i mala razlika potencijala dovoljna i elektroni koji se kaotično kreću počinju se kretati u strogo uređenom smjeru. Najoptimalniji vodiči električne struje su metali kao što su srebro, bakar, zlato i aluminij. U tom slijedu njihova električna vodljivost opada.
Osim toga, slobodni elektroni su razlog zašto metali sjaje. Svjetlo  apsorbira površina metala, njegovi elektroni počinju emitirati vlastite, sada sekundarne, valove zračenja, možemo ih promatrati kao metalni sjaj. Dobar primjer U tu svrhu mogu poslužiti metali kao što su živa, bakar i srebro - oni savršeno reflektiraju svjetlost.
apsorbira površina metala, njegovi elektroni počinju emitirati vlastite, sada sekundarne, valove zračenja, možemo ih promatrati kao metalni sjaj. Dobar primjer U tu svrhu mogu poslužiti metali kao što su živa, bakar i srebro - oni savršeno reflektiraju svjetlost.
Velik broj metala pojavljuje se u prirodi u obliku ruda i raznih spojeva. Mogu tvoriti sulfide, okside, karbonate i mnoge druge kemijske spojeve. Za dobivanje čistog metala iz rude potrebno ga je izolirati i pročistiti. Ako se ukaže potreba, provodi se legiranje i druga obrada metala. Znanost koja proučava metale, kao i sve što je s njima povezano, zove se metalurgija.
Još uvijek imate pitanja? Ne znate kako napraviti domaću zadaću?
Za pomoć od mentora, registrirajte se.
Prvi sat je besplatan!
www.site, pri kopiranju materijala u cijelosti ili djelomično, poveznica na izvorni izvor je obavezna.
Sažetak lekcije
u kemiji
u 8. razredu
na temu
"Jednostavne tvari - metali"
Tema: Jednostavne tvari – metali
Ciljevi:
Obrazovni:
1. Proširivanje i produbljivanje znanja učenika o strukturnim značajkama atoma metala, rasporedu metala u periodnom sustavu kemijskih elemenata D.I. Mendeljejev, struktura kristalne metalne rešetke i metalne kemijske veze.
2. Upoznati opća fizikalna svojstva metala.
3. Naučiti karakterizirati i objasniti svojstva tvari na temelju vrste kemijske veze i vrste kristalne rešetke.
Obrazovni:
1. Razvoj općih obrazovnih vještina (sposobnost uspoređivanja, generaliziranja i zaključivanja).
2. Razvoj kognitivne aktivnosti, kognitivnih i intelektualnih sposobnosti učenika, sposobnosti samostalnog stjecanja znanja.
3. Formiranje znanstvene slike svijeta.
Obrazovni:
1. Doprinijeti razvoju interesa za predmet.
2. Poticanje marljivog rada i pažnje.
Oprema: računalo, projektor.
Metode rada: priča, razgovor, strukture singapurskih nastavnih metoda.
Tijekom nastave:
ja Organiziranje vremena.
Pozdrav, priprema učenika za nastavu. Stolovi su raspoređeni u parovima, učenici sjede po 4 osobe za stolom. Stolovi su numerirani.
II. Obnavljanje znanja.
Priopćavanje teme i ciljeva lekcije
Slajd broj 1
U starom Egiptu vjerovali su da postoji samo 7 metala!
Sedam metala stvorilo je svjetlost prema broju sedam planeta
Bakar, željezo, srebro... svemir nam je dao dobre stvari.
Zlato, kositar, olovo... Merkur je otac svih njih.
Slajd br. 2
Dečki, slušali ste pjesmu koja govori o temi današnje lekcije. Formulirajte temu lekcije.
Odgovor: Metali
Slajd br. 3
Tako je, u današnjoj lekciji ćemo govoriti o metalima. Zapišite temu lekcije "Jednostavne tvari - metali" u svoje bilježnice.
2. Obnavljanje prethodno naučenog znanja
Obratite pozornost na temu lekcije. Pojmovi "jednostavne tvari" i "metali" već su nam poznati. Prisjetimo se koje se tvari nazivaju jednostavnima?
Odgovor: Tvari koje se sastoje od atoma iste vrste nazivamo jednostavnim tvarima.
Što već znate o metalima?
Odgovor: Struktura metala, položaj metalnih elemenata u periodnom sustavu, metalne kemijske veze.
Ispunite stupac "PRIJE" u tablici ispred sebe (struktura Singapore AR Guide). (dodijeljeno 2 minute) (Dodatak 1)
Sada stavite lišće na rub stola, vratimo se ovom zadatku na kraju lekcije.
Prisjetimo se rasporeda metala u PSHE.
Ako povučete dijagonalu od elementa bora B (redni broj 5) do elementa astatina At (redni broj 85), tada su dolje lijevo ispod ove dijagonale u periodnom sustavu svi elementi metali, osim toga, svi elementi sekundarnog podskupine su metali. Gore desno iznad dijagonale su elementi nemetali (isključujući metale sekundarnih podskupina).
Koji se elementi nalaze u periodnom sustavu D.I. Više Mendeljejeva?
Odgovor: Postoji više metala u periodnom sustavu D. I. Mendeljejeva.
Nacrtajte dijagram s ploče u svoju bilježnicu. (Dodatak 2)
Od 110 elemenata tablice D. I. Mendeljejeva, 88 su metali, a samo 22 su nemetali.
S lijeva na desno kroz razdoblje, metalna svojstva i R atoma se smanjuju.
Od vrha do dna skupine povećavaju se metalna svojstva kemijskih elemenata i R atoma.
- Koliko elektrona imaju metali na svojoj vanjskoj energetskoj razini?
Odgovor: Od 1 do 3 elektrona na vanjskoj energetskoj razini.
- Znajući da metali imaju relativno velike atomske radijuse i mali broj elektrona na vanjskoj energetskoj razini, odgovorite čemu teže atomi metala?
Odgovor: Atomi metala imaju tendenciju otpuštanja elektrona s vanjske energetske razine.
U što će se pretvoriti atomi metala koji predaju svoje elektrone?
Odgovor: Atomi metala postaju pozitivno nabijeni ioni.
Slajd br. 4
Jednostavne tvari koje tvore elemente - metali, u normalnim su uvjetima čvrste kristalne tvari, osim žive i olova.
Prisjetimo se strukture kristalne rešetke metala.
Odgovor: U čvorovima metalne kristalne rešetke nalaze se pozitivni ioni i atomi metala (atom-ioni), a između njih slobodni elektroni. Ovi elektroni se slobodno kreću. Slobodni elektroni imaju negativan naboj i privlače pozitivno nabijene metalne ione. Stoga je kristalna rešetka metala stabilna.
- Pravo , Atomi, ioni i slobodni elektroni stalno postoje u metalu. Na ploču nacrtajte dijagrame metalnih kemijskih veza za Na, Mg, Al.
Učenici se jedan po jedan prozivaju pred ploču, a svi ostali to rade u svojim bilježnicama.
odgovori:
Li 0 -1 ē Li 1+
Ca 0 -2 ē Ca 2+
Al 0 -3 ē Al 3+
Provjerite svoje bilješke.
Sjećate se kako se zove veza između pozitivnih metalnih iona i slobodnih elektrona u metalnoj kristalnoj rešetki?
Odgovor: Metalna veza.
Slobodni elektroni unutar metalne kristalne rešetke mogu prenositi toplinu i elektricitet te reflektirati svjetlosne valove, pa su razlog glavnih fizikalnih svojstava metala - visoke električne i toplinske vodljivosti.
Slajd br. 5
III. Učenje novog gradiva.
Počinjemo proučavati "Fizička svojstva metala".
Sada ćemo proučiti fizikalna svojstva metala, koja morate navesti u svojoj bilježnici. Istovremeno ćemo snimati informacije s ekrana.
1. Tvrdoća – Svi su metali u normalnim uvjetima čvrste tvari, osim žive. (Pogledajte video “Merkur” )
Prema tvrdoći metali se dijele na meke i tvrde. Najtvrđi metal je krom koji može izgrebati staklo. Najmekši su alkalijski metali i olovo. (Video demonstracija “Alkalijski metali – litij, natrij, kalij”). Alkalijski metali čuvaju se u posebnim uvjetima: litij u vazelinu zbog male gustoće, natrij u kerozinu, kerozin u obloženoj posudi, posuda u azbestnim komadićima, azbest u limenoj posudi, limenka u sefu.
Slajd br. 6
2. Plastičnost, savitljivost – Ovo je svojstvo metala da mijenjaju svoj oblik pri udaru. Razvaljano u tanke listove i izvučeno u žicu. Mehaničko djelovanje na kristal s metalnom rešetkom uzrokuje samo pomicanje slojeva atoma i nije popraćeno prekidom veze, pa stoga metal karakterizira visoka plastičnost.
Najduktilniji od plemenitih metala je zlato. Jedan njegov gram može se uvući u žicu dugu 2 km. Učenicima demonstrirati aluminijsku foliju.
Slajd br. 7
3. Metalni sjaj – Svi metali imaju metalni sjaj. Elektroni koji ispunjavaju međuatomski prostor reflektiraju svjetlosne zrake, a ne propuštaju ih kao staklo. Najsjajniji metali su živa i srebro. Od žive su se u srednjem vijeku izrađivala poznata “mletačka ogledala”, a moderna ogledala od srebra.
Slajd br. 8
4. Metalni prsten – ovo svojstvo se koristi za izradu zvona, glazbeni instrumenti itd. najzvučniji metali su zlato, srebro i bakar.
Demonstracija zvonjenja zlatnog vjenčanog prstena obješenog o žensku kosu. Kad ga pogodiš drveni štap(olovkom) čuje se vrlo dug, visok i jasan zvuk.
Slajd br. 9
5. Toplinska i električna vodljivost – metali karakterizirani visokom električnom vodljivošću imaju i visoku toplinsku vodljivost. Najbolji vodiči su srebro, bakar, zlato, željezo, aluminij.
Ako je najbolji dirigent srebro, zašto onda? električne žice zar nisu napravljeni od toga?
Odgovor: Visoka cijena ovaj metal.
Najlošiju toplinsku i električnu vodljivost imaju živa te olovo i volfram.
Slajd br. 10
6. Talište metala uvelike varira. Najtaljiviji metal je živa (t 0 pl. = -38,9 0 C), najvatrostalniji je volfram (t 0 pl. = 3380 0 C).
Slajd br. 11
7. Gustoća metala također varira u širokom rasponu. Metal s najmanjom gustoćom je litij 0,53 * 10 3 kg/m 3. Metal s najvećom gustoćom je osmij 22,48 * 10 3 kg/m 3.
Slajd br. 12
8. Alotropija- sposobnost atoma jednog kemijskog elementa da tvore više jednostavnih tvari – modifikacije.
Priča učitelja o alotropskim modifikacijama kositra.
IV. Fizmunutka
Slajd br. 13-24
Sad se malo odmorimo. Pažljivo pogledajte ekran; na njemu će se pojaviti nazivi kemijskih elemenata. Ako ima metala na ekranu, morate ustati, ako ne, nastavljamo sjediti (Singapurska struktura "Take of Touch Down"). Pažnja na ekran!
Vratimo se sada tablicama koje smo ispunili na početku lekcije. Samo sada ispunite stupac "Nakon". (Dano vrijeme - 2 minute)
Je li se vaše mišljenje promijenilo?
Odgovor:
Pročitaj mi svoje rezultate, tablica br.... Sudionik br.... (pa učitelj pita nekoliko učenika)
Na kraju ćemo provjeriti što ste naučili na današnjoj lekciji. Da biste to učinili, uzmite A4 list koji se nalazi na vašim stolovima. Presavijte na 4, zatim preklopite kut i otvorite list. (Okvir singapurskog Freierovog modela) (Dodatak 3)
(Dato 10 minuta)
Sada, redom za svakim stolom, pročitajte svoje odgovore ("Single Round Robin"). (30 sekundi za svakog učenika)
Tablica br...., sudionik br...., pročitajte svoje odgovore (pitajte nekoliko učenika)
VIII. Domaća zadaća:
Slajd br. 25
Prilog 1
Hej-ar-vodiču
PRIJE
Izjave
NAKON
Svi metali su čvrsti u svom agregatnom stanju
Svi metali su vatrostalni
Metali dobro provode struju
Svi metali imaju visoku gustoću
Metali imaju sjaj

Metali


Primjeri
Protuprimjeri
Od 114 kemijskih elemenata periodnog sustava D. I. Mendeljejeva, 92 elementa tvore jednostavne tvari s metalnom vezom u slobodnom stanju.
Još u davnim vremenima ljudi su obraćali pozornost na posebna svojstva metala: mogu se taliti i potom im dati bilo koji oblik, izrađujući vrhove strijela i kopalja, štitove i mačeve, posuđe i plugove... U satu ljudske povijesti Kamen Doba je ustupilo mjesto bakrenom dobu, zatim - brončanom, pa - željeznom...
Svi metali, osim žive, čvrste su tvari u svom normalnom stanju i imaju niz zajedničkih svojstava. Metali su kovne, plastične, viskozne tvari koje imaju metalni sjaj te su toplinski i električki vodljive.
U prošlim stoljećima metalima su se pripisivala mnoga čudesna svojstva. Poznato još u starom Egiptu, sedam metala smatralo se predstavnicima sedam planeta na Zemlji.
Naši su preci povezivali zlato sa Suncem, srebro s Mjesecom, bakar s Venerom, željezo s Marsom, kositar s Jupiterom, olovo sa Saturnom, živu s Merkurom (slika 44). Čini se da podudarnost broja metala poznatih starim ljudima s brojem planeta koje su vidjeli na nebu potvrđuje odnos zemaljskih metala s nebeska tijela. Kada je u 16.st Alkemičari su postali svjesni metalnog antimona, ali su ga dugo odbijali prepoznati kao metal - uostalom, nije bilo dovoljno planeta na nebu za antimon.
Riža. 44.
Označavanje kemijskih elemenata kod alkemičara
M. V. Lomonosov definirao je metal "kao lagano tijelo koje se može kovati", a to svojstvo pripisao je metalima: zlatu, srebru, bakru, kositru, željezu i olovu. A. Lavoisier u svom “Početnom tečaju kemije”, napisanom 1789. godine, već spominje 17 metala. U početkom XIX V. nakon čega je uslijedilo otkriće metala platine. Do danas se broj poznatih metala povećao na 92.
Plastičnost je najvažnije svojstvo metala da pri udaru mijenjaju oblik, da se valjaju u tanke listove i izvlače u žicu. U isto vrijeme, mobilni socijalizirani elektroni ublažavaju kretanje pozitivnih iona, štiteći ih jedne od drugih. Stoga se obrada metala s promjenom oblika odvija bez razaranja.
Najduktilniji od plemenitih metala je zlato. Jedan gram zlata može se uvući u žicu dugu dva kilometra.
Svi su metali, kao što znate, u normalnim uvjetima čvrste tvari. Iznimka je, kao što je već navedeno, živa, koja je u normalnim uvjetima tekući, sjajni srebrnobijeli metal.
Metali se razlikuju po tvrdoći. Meki su lužnati, na primjer, ili olovni, a tvrdi su krom, titan, molibden.
Možete dobiti predodžbu o talištu i gustoći nekih metala ako pažljivo pregledate sliku 45.

Riža. 45.
Tališta i gustoće nekih metala
Prisutnost socijaliziranih elektrona također objašnjava takva karakteristična svojstva metala kao što su njihova toplinska i električna vodljivost. Čak je i mala razlika potencijala dovoljna i elektroni koji se nasumično kreću počinju se kretati na strogo uređen način. Najbolji vodiči električne struje su srebro, bakar, zlato, aluminij. Na gornjem popisu raspoređeni su prema padajućem redoslijedu električne vodljivosti.
Slobodni elektroni također uzrokuju takva svojstva kao što je metalni sjaj. Svjetlost se apsorbira na površini metala, a njegovi elektroni počinju emitirati vlastite, sekundarne, valove zračenja, koje percipiramo kao metalni sjaj. Paladij, živa, srebro i bakar savršeno reflektiraju svjetlost.
Laboratorijski pokus br. 5
Upoznavanje sa zbirkom metala
Pogledajte kolekciju metala. Zapišite kemijske simbole metala koji su vam dani, poredajte ih uzlaznim redoslijedom:
- gustoća;
- plastičnost;
- tvrdoća;
- metalni sjaj;
- električna provodljivost;
- toplinska vodljivost.
Za rješavanje zadatka koristite priloge 1 i 2, dodatne izvore informacija.
Ključne riječi i izrazi
Fizikalna svojstva metala: kovnost, duktilnost, duktilnost, tvrdoća, vrelište, metalni sjaj, električna i toplinska vodljivost.
Rad s računalom
- Pogledajte elektroničku prijavu. Proučite gradivo lekcije i izvršite dodijeljene zadatke.
- Potražite na internetu adrese e-pošte koje mogu poslužiti dodatni izvori, otkrivajući sadržaj ključnih riječi i fraza u odlomku. Ponudite svoju pomoć učitelju u pripremi nove lekcije – napravite izvještaj o ključnim riječima i izrazima sljedećeg odlomka.
Pitanja i zadaci
- Koja od tvari navedenih u pjesmi u nastavku nije metal?
Sedam metala stvorilo je svjetlost
Prema broju od sedam planeta:
Bakar, željezo, srebro...
Dao nam je Kozmos zauvijek.
Zlato, kositar, olovo...
Sine moj, Sera je njihov otac.
A trebali biste također znati:
Merkur im je svima majka. - Kako razumjeti figurativne izraze date u ovoj pjesmi: “sumpor im je otac” i “živa im je vlastita majka”?
- Koje se svojstvo metala spominje u uvodnom retku pjesme A. S. Puškina "Bodež"?
Bog Lemnosa te je vezao...
Kao paklena zraka, kao munja bogova,
Tiha oštrica sjaji u očima zlikovca,
I, gledajući oko sebe, dršće
Među njihovim gozbama... - Zašto je zračnim prijevoznicima zabranjen transport uređaja i opreme koji sadrže živu?
- Koristeći dodatnu literaturu pripremite poruku o pojavi zrcala u životu čovjeka i usavršavanju metoda za njihovu izradu.
