Formula za izračunavanje količine oslobođene topline. Količina topline. određena toplina. formula za izračunavanje količine topline koja se oslobađa ili apsorbira pri promjeni tjelesne temperature
Zadaci izračunavanja količine topline rješavaju se pomoću formule.Kako bi se spriječilo mehaničko pamćenje formule, potrebno je, osobito na početku proučavanja teme, pitati učenike o njezinu značenju i njezinu izvođenju iz razmišljanja pomoću pojma specifični toplinski kapacitet tvari. U početku se pomoću formule izvode samo izravni izračuni, tj. nalaze količina topline Pronalaženje drugih veličina, a posebno temperatura nije lak zadatak za mnoge učenike. Ovdje se stalno treba pozivati na znanje učenika iz matematike i strpljivo objašnjavati bit materije na jednostavnim brojčanim primjerima. Pritom se trebate dogovoriti s profesorom matematike da tijekom satova algebre s učenicima ispita nekoliko problema koji se svode na rješavanje jednadžbi npr. toplinska ravnoteža.
Prilikom rješavanja zadataka pomoću formule učenici trebaju obratiti pozornost na činjenicu da je za pronalaženje topline koju tijelo prima ili predaje potrebno znati apsolutnu vrijednost temperaturne razlike. Stoga se pri izračunu manja temperatura oduzima od veće apsolutne vrijednosti temperature. Oduzimanje početne temperature od konačne temperature u nekim slučajevima može dovesti do negativne toplinske vrijednosti, što će zahtijevati dodatna objašnjenja ili, kod rješavanja zadataka na jednadžbu toplinske bilance, do općenito netočnog odgovora.
Problemi vezani uz izračunavanje količine topline trebaju biti što jednostavniji. Složenije zadatke u redoslijedu ponavljanja i produbljivanja gradiva treba rješavati pri učenju molekularne fizike u IX. Za stvaranje vizualnih slika i ideja o toplinskim procesima poželjno je imati širi raspon

koristiti grafičke metode rješavanje problema. Nažalost, do vremena kada smo studirali ovog materijala Učenici VII razreda još nemaju vještine crtanja grafikona. Stoga nastavnik fizike treba održati poseban sat na ovu temu.
190. Zagrijali su 1 kg vode i željeza za Koliko im se promijenila unutarnja energija i kako se ta promjena može objasniti molekularnom teorijom?
191. Što će se brže ohladiti sa 100° C na sobnu temperaturu: željezno glačalo ili aluminijski kuhalo za vodu, čija je masa zajedno s vodom jednaka masi željeza?
192(e). Pomoću toplomjera i čaša s vrućim i hladna voda Odredite koje od dva tijela malog volumena ima veći toplinski kapacitet.
193. Na slici 28 prikazan je graf promjene temperature vode, bakra i željeza, dobivenih zagrijavanjem na plamenicima koji u jednakim vremenskim razmacima proizvode istu količinu topline. Označite koja je građena za vodu, koja je građena za bakar, a koja za željezo.
194. Zagrijana na peći aluminijska posuda sa vodom. Masa posude s vodom - Konstruirajte približne grafikone povećanja topline koju tijekom vremena primaju voda i posuda.
195. Na temelju podataka iz prethodnog zadatka izračunaj koliko je topline potrebno da se voda i lonac zagriju od 10 do 60°C.
Riješenje. Količina topline koju primi tava:
Količina topline koju prima voda:
196. Da bi se odredio specifični toplinski kapacitet čelika, čelično tijelo s masom zagrijanom na 100 ° C spušteno je u kalorimetar s vodom od 13 ° C. Temperatura vode u kalorimetru porasla je na Pronađite specifični toplinski kapacitet željezo.
Riješenje. Zadatak se razmatra u vezi s provedbom laboratorijski rad određivanjem specifičnog toplinskog kapaciteta krutine. Zahtijeva sastavljanje i rješavanje jednadžbe toplinske bilance.
S obzirom na nedovoljnu matematičku pripremljenost učenika, potrebnoj se jednadžbi pristupa postupno, prvo se obavlja niz međuradnji. To jest, problem treba riješiti sintetičkom metodom, po mogućnosti pitanjima, bez pokušaja dobivanja jednadžbe u općem obliku.
Nema potrebe za upisivanjem posebne oznake temperature smjese slovom u klasu VII.
1. Koliko je topline voda primila?
2. Koliko je topline tijelo predalo?
Prema zakonu održanja energije, deg.
3. Čemu je to jednako? određena toplina postati?
![]()
Prilikom analize rješenja učenicima treba skrenuti pozornost da u prvoj aproksimaciji nisu uzeti u obzir gubici topline zbog zagrijavanja kalorimetra, zraka i sl.
Učenici bi trebali u potpunosti ovladati tehnikama sastavljanja jednačina toplinske bilance u IX razredu. Na primjeru zadataka 197 i 198 objasnit ćemo neka pitanja o metodologiji rješavanja zadataka ove vrste.
197. Najprije je u posudu ulivena voda temperature a zatim voda temperature Odredi temperaturu smjese. Zanemarite zagrijavanje posude.
Rješenje 1. Dogovorimo se da na lijevoj strani jednadžbe zapišemo članove koji se odnose na predanu toplinu, a na desnu - članove koje tijela primaju.
Ako prilikom rješavanja ovog zadatka učenik pronađe razliku između početne i konačne temperature, dobit će jednadžbu deg i smiješan odgovor
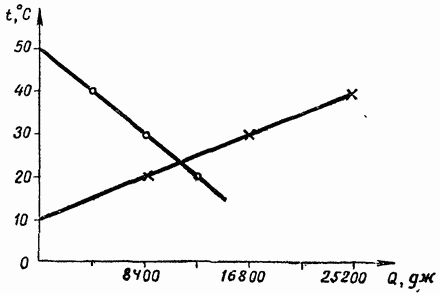
Rješenje 2. Sastavimo tablicu i pomoću njenih podataka konstruirajmo grafikon zagrijavanja i hlađenja uzetih količina vode (slika 29).
(vidi sken)
Grafikon nacrtan na kockastom papiru u đačkoj bilježnici daje, na drugu decimalu, istu vrijednost kao i izračuni pomoću jednadžbe toplinske bilance.
198. Željezo i 10° bakra stave se u 200 g vode temperature 20° C. Nađi temperaturu smjese.
Riješenje. Složenost problema je u tome što nije jasno da li voda odaje ili prima toplinu. Međutim, pri rješavanju ćete dobiti točan odgovor ako slijedite opće pravilo: zapišite toplinu koju tijela predaju na lijevu stranu jednadžbe i oduzmite manju od navodno više temperature. Dobiti kurac sa negativan predznak ekvivalentan je prijenosu u drugi dio jednadžbe s predznakom plus (pravilo vrijedi u nedostatku agregatnih transformacija).
Pretpostavimo da voda prima toplinu
Ako pretpostavimo da se voda hladi, tada će jednadžba poprimiti oblik
Obje jednadžbe će dati isti odgovor. Međutim, druga jednadžba ispravno opisuje proces, na što učenici trebaju obratiti pozornost pri analizi dobivenog rezultata.
Količina topline– energija koju tijelo prima ili gubi tijekom prijenosa topline.
Količina topline, potrebno za tijelo za grijanje, ovisi o njegovoj m, temperaturnoj razlici i vrsti tvari.
Q je količina topline.
Što je tijelo veće m, bit će potreban veći Q. Pri hlađenju tijelo prenosi to veći Q što mu je veći m.
Količina topline može se mjeriti kalorimetrom.
Određena toplina– potrebna količina topline dato tijelo težine 1 kg, za zagrijavanje za 1°C.
s () – specifični toplinski kapacitet. Različit je u različitim tvarima.
Na primjer: voda = 4200 (), led = 2100 ().
Izračun Q:
Q = cmDt
Dt = t k - t n
Tijekom izmjene topline U grijućih tijela raste za onoliko koliko se U rashladnih tijela smanjuje.
Q 1 = Q 2 – jednadžba toplinske bilance.
ULAZNICA br. 7
TALENJE I OKRUĆIVANJE KRISTALNIH TIJELA. SPECIFIČNA TOPLINA TALANJA. OBJAŠNJENJE PROCESA TALJENJA I OKRUĐIVANJA NA TEMELJU PROUČAVANJA MOLEKULARNE STRUKTURE TVARI.
Topljenje– prijelaz tvari iz krutog u tekuće stanje.
Temperatura topljenja- temperatura na kojoj se tvari tale.
Tvari se skrućuju pri istoj konstanti t kao što se tale. Amorfna tijela nemaju određeno talište.
Sva energija koja se dovodi tijelu tijekom taljenja troši se na uništavanje kristalne rešetke, a tijekom skrućivanja - na njezino poravnanje.
Tijekom tih procesa E k ostaje isti, ali se E p mijenja.
Specifična toplina taljenja– fizikalna veličina koja pokazuje koliko topline treba predati kristalnom tijelu mase 1 kg da bi se potpuno pretvorilo u taljenje t tekuće stanje.
l () - specifična toplina taljenja.
Q = lm
Zagrijavanjem do t taljenja povećava se prosječna brzina gibanja molekula Þ povećavaju se E k i t Þ povećava se opseg titranja molekula, remeti se poredak čestica Þ taljenje.
Tijekom kristalizacije smanjuje se E k i brzina molekula u ohlađenoj tvari, sređuje se raspored molekula i gradi se kristalna rešetka.
ULAZNICA br. 8
ISPARAVANJE I KONDENZACIJA. RAZLOZI O KOJIMA OVISI BRZINA ISPARAVANJA TEKUĆINE. OBJAŠNJENJE PROCESA NASTANKA PARE NA TEMELJU PROUČAVANJA MOLEKULARNE STRUKTURE TVARI.
Isparavanje– pretvaranje tekućine u paru.
Isparavanje– isparavanje s površine tekućine. 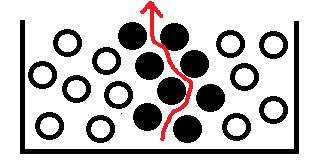
Pri gibanju molekule se približavaju prema gore (površini tekućine), a ako je njihov E k veći od E n, tada molekula napušta tekućinu.
Brzina isparavanja tekućine ovisi o:
2. Vrsta tvari
3. S površina
4. Stanja vodene pare
Isparavanje = kondenzacija
Kondenzacija– pretvaranje pare u tekućinu.
Kondenzacija je popraćena oslobađanjem energije.
Primjer isparavanja i kondenzacije je kruženje vode u prirodi.
Što će se brže zagrijati na štednjaku - čajnik ili kanta vode? Odgovor je očit - čajnik. Onda je drugo pitanje zašto?
Odgovor nije ništa manje očit - jer je masa vode u kotliću manja. Sjajno. A sada možete i sami kod kuće napraviti pravo fizičko iskustvo. Da biste to učinili, trebat će vam dvije identične male posude, jednaka količina vode i biljno ulje, na primjer, pola litre i štednjak. Na istu vatru stavite lonce s uljem i vodom. Sada samo gledajte što će se brže zagrijati. Ako imate termometar za tekućine, možete ga koristiti, ako nemate, možete samo povremeno ispitati temperaturu prstom, samo pazite da se ne opečete. U svakom slučaju, ubrzo ćete vidjeti da se ulje zagrijava puno brže od vode. I još jedno pitanje, koje se također može implementirati u obliku iskustva. Što će brže prokuhati - Topla voda ili hladno? Opet je sve očito – topli će biti prvi na cilju. Čemu sva ta čudna pitanja i eksperimenti? Odrediti fizička količina, koja se naziva "količina topline".
Količina topline
Količina topline je energija koju tijelo gubi ili dobiva tijekom prijenosa topline. To je jasno iz naziva. Hlađenjem će tijelo gubiti određenu količinu topline, a grijanjem će je apsorbirati. A odgovori na naša pitanja pokazali su nam O čemu ovisi količina topline? Prvo, što više tjelesna masa, to više topline mora biti utrošeno da se promijeni njegova temperatura za jedan stupanj. Drugo, količina topline potrebna za zagrijavanje tijela ovisi o tvari od koje se ono sastoji, odnosno o vrsti tvari. I treće, razlika u tjelesnoj temperaturi prije i poslije prijenosa topline također je važna za naše izračune. Na temelju navedenog možemo odredite količinu topline pomoću formule:
Q=cm(t_2-t_1) ,
gdje je Q količina topline,
m - tjelesna težina,
(t_2-t_1) - razlika između početnog i završnog tjelesne temperature,
c je specifični toplinski kapacitet tvari, koji se nalazi iz odgovarajućih tablica.
Pomoću ove formule možete izračunati količinu topline koja je potrebna za zagrijavanje bilo kojeg tijela ili koju će to tijelo osloboditi pri hlađenju.
Količina topline se mjeri u džulima (1 J), kao i svaka vrsta energije. Međutim, ova vrijednost je uvedena ne tako davno, a ljudi su počeli mjeriti količinu topline mnogo ranije. I koristili su jedinicu koja se naširoko koristi u naše vrijeme - kalorija (1 cal). 1 kalorija je količina topline potrebna za zagrijavanje 1 grama vode za 1 stupanj Celzija. Vođeni ovim podacima, oni koji vole brojati kalorije u hrani koju jedu mogu, onako iz zabave, izračunati koliko litara vode mogu prokuhati s energijom koju unesu hranom tijekom dana.
